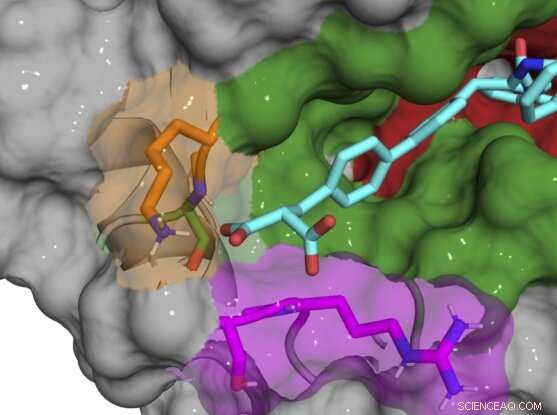
Röntgensamkristallstruktur av B52-förening (cyan) som binder och hämmar Cyclophilin D-protein. Kredit:Aziz Rangwala
Cyklosporin är ett av de vanligaste och mest effektiva immunsuppressiva läkemedlen som används för att behandla kroniska sjukdomar som artrit och psoriasis, men det medför en risk för allvarliga biverkningar. Forskare tror att det kan bero på att läkemedlet i stora drag riktar sig mot cyklofiliner, en familj av 17 regulatoriska proteiner som spelar olika roller för att främja cellulär hälsa. Även om varje enskild cyklofilinsubtyp har en unik roll, riktar många nuvarande immunsuppressiva läkemedel mot hela familjen, vilket innebär att viktiga okända vägar kan stängas av av misstag eller på annat sätt ändras.
Problemet kompliceras av det faktum att det aktiva stället där molekyler binder är nästan identiskt över alla 17 cyklofiliner, vilket gör det svårt för läkemedelstillverkare att rikta in sig på specifika subtyper. I en artikel publicerad idag i Nature Chemical Biology , forskare i labbet för Broad Institute Core Member David Liu, som också är chef för Merkin Institute of Transformative Technologies in Healthcare på Broad, i samarbete med Labs av Markus Seeliger vid SUNY Stony Brook och Institute Member Vamsi Mootha vid Massachusetts General Sjukhuset har föreslagit en ny lösning.
Istället för att rikta in sig på den aktiva platsen för cyklofilinproteiner, beskriver forskare i Lius labb en process som hittar föreningar som binder till "exo-platsen", en liten ficka bredvid den aktiva platsen som varierar i storlek och form över olika cyklofiliner. Med hjälp av isolerade proteiner i ett provrör upptäckte teamet flera föreningar som exklusivt binder och hämmar Cyclophilin D (CypD), ett protein som är involverat i öppning och stängning av mitokondriella porer. De tillämpade också liknande principer för att upptäcka unika, selektiva hämmare för Cyclophilin E (CypE). Författarna säger att deras studie lägger grunden för forskare att utveckla ytterligare subtypselektiva cyklofilinhämmare, av vilka några kan vara användbara som verktyg för biologi eller som led för terapeutisk utveckling.
"Det är ett nytt bindningsläge som drar nytta av en ficka som folk inte har utforskat till fullo ännu," sa huvudförfattaren Alex Peterson, nu postdoktor vid Scripps Research Institute, som ledde projektet som doktorand i Lius labb, säger . "Det är en slags plan för hur människor kan designa selektiva cyklofilinhämmare framöver."
Använda ny och gammal teknik
CypD reglerar den mitokondriella permeabilitetsövergångsporen (mPTP), små porer som ligger på den inre ytan av mitokondrierna (känd som cellens kraftpaket). När CypD upptäcker oxidativ stress eller höga kalciumnivåer skyndar det sig att öppna mPTP, vilket låter vatten och andra joner rusa in och ut ur mitokondrierna.
Denna öppning av mitokondriella slussar kan bli ett problem med sjukdomar som ischemi reperfusionsskada, diabetes, neurodegenerativa störningar, leversjukdomar och mer. Eftersom dessa tillstånd kan orsaka onormalt höga nivåer av oxidativ stress, håller CypD de mitokondriella porerna öppna längre än vanligt, vilket orsakar mitokondriell dysfunktion, bristning och celldöd. Man har trott att läkemedel som bromsar och hämmar CypD:s reaktion på hög oxidativ stress kan användas för att behandla en mängd sjukdomar.
För att spåra föreningar som exklusivt binder till CypD vände sig teamet till DNA-kodade småmolekylbibliotek, en teknologi som utvecklades för över tjugo år sedan som ett av de första projekten i Lius då nya labb. Forskare kan använda biblioteken, som är fyllda med hundratusentals syntetiska föreningar fästa på unika DNA-streckkoder, för att söka efter molekyler som binder till önskade proteiner. Genom att blanda isolerade CypD-proteiner och en samling av 256 000 unika DNA-kodade föreningar i ett provrör, identifierade teamet hundratals lovande föreningar.
De flesta av de initiala föreningarna är fortfarande bundna i och runt den aktiva platsen, vilket hämmar flera cyklofilinsubtyper, så teamet gjorde gradvis små kemiska förändringar i sina föreningar för att göra dem unika för CypD. När de upptäckte att exo-platsen var nyckeln till att utveckla subtypspecifika hämmare, kunde de designa ett par föreningar som kraftigt hämmar CypD samtidigt som de påverkar andra cyklofiliner minimalt. Röntgensamkristallstrukturer av CypD-proteinet och inhibitorerna under utvecklingen gav teamet en titt bakom kulisserna på den exakta platsen där deras molekyler binder.
Forskarna behandlade sedan isolerade mitokondrier med sina två ledande föreningar och observerade att de var effektiva för att bromsa CypD:s öppning av mitokondriella porer. Spegelbilderna av deras föreningar, som inte hämmar CypD, visade inte aktivitet i mitokondrier. För att bevisa att deras framgång inte var en isolerad incident, upprepade de strategin igen för CypE, ett cyklofilin som ansvarar för att reglera mRNA-bearbetning. Än en gång utvecklade de en förening som uteslutande riktade sig mot den och lämnade de återstående 16 cyklofilinerna opasade.
Teamet hoppas att deras resultat i slutändan kan hjälpa kemiska biologer och läkemedelstillverkare att bygga bättre och mer specifika cyklofilininriktade läkemedel. De gav till och med framtida forskare ett ben – eftersom de CypD-riktade föreningarna kämpar för att komma in i mänskliga celler på egen hand, anpassade teamet dem genom att lägga till esterderivat som effektivt kringgår plasmamembranet och levererar till mitokondrier.
"Vårt teams arbete tillät oss så småningom att övervinna detta långvariga problem:hur hämmar man selektivt bara en cyklofilinsubtyp av 17?" sa Liu, som också är utredare vid Howard Hughes Medical Institute. "I framtiden kommer molekyler som kommer från att använda vår strategi, hoppas jag, visa sig vara användbara både för grundläggande vetenskap och potentiellt för terapi." + Utforska vidare