Grafiskt abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01049-9
I en ny studie publicerad i Nature Chemical Biology , har forskare vid Children's Hospital of Philadelphia (CHOP) avslöjat den molekylära mekaniken hos en cellytemolekyl som är ett potentiellt mål för immunterapi. Med hjälp av sofistikerade tekniker, inklusive kärnmagnetisk resonans (NMR)-spektroskopi, visade forskarna vikten av så kallade chaperonmolekyler för att stabilisera detta mål, känt som MHC-I-relaterat protein 1 (MR1).
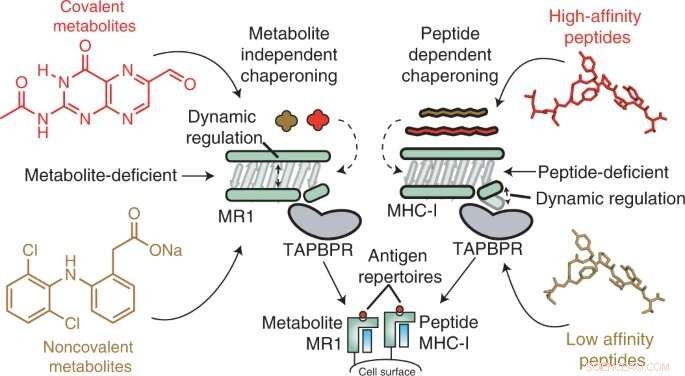
Major histokompatibilitetskomplex klass I (MHC-I) molekyler lever på ytan av nästan alla celler och presenterar peptidantigener för immunsystemet, så att immunceller kan upptäcka när ett främmande antigen är närvarande, såsom de från bakterier, virus eller även utveckla tumörer. I en liknande process presenterar det MHC-I-relaterade proteinet 1 (MR1) mindre metaboliter på sin yta för övervakning av MR1-specifika immunceller, nämligen mukosalassocierade invarianta T-celler (MAIT).
MR1 är känt för att vara viktigt för erkännande av mikrobiella infektioner, identifiering av cancerceller i motsats till friska, och reglering av autoimmuna sjukdomar. Nyligen genomförda studier tyder också på att MR1 kan visa ett mycket bredare spektrum av molekyler, inklusive cancerspecifika metaboliter, som kan fungera som interna sensorer för sjukdomar. Dessutom varierar MR1 inte mellan den mänskliga befolkningen, vilket gör det till ett lovande potentiellt immunterapimål. Före denna studie var dock den molekylära mekaniken för MR1 okänd – närmare bestämt vilken roll chaperonemolekyler spelar för att känna igen och stabilisera MR1-molekyler.
Med hjälp av in vitro- och celltekniker fann forskarna att MR1 fungerar annorlunda än MHC-I, särskilt när det gäller molekylär belastning och affinitet för de molekylära chaperonerna Tapasin och TAPBPR. Medan MHC-1 visade en hög affinitet för molekylära chaperoner när den var tom men låg affinitet när den laddades med presenterande antigener, interagerade MR1 på lika låga nivåer med TAPBPR oavsett om den var laddad med metaboliter eller inte. Trots komplexets korta livslängd använde forskare NMR för att framgångsrikt bestämma dess 3D-struktur i en fysiologiskt relevant, vattenhaltig miljö. Intressant nog gjorde dessa lågaffinitetsinteraktioner fortfarande att chaperoner kunde katalysera laddning och utbyte av metabolitmolekyler direkt på MR1-ytan.
"Våra resultat ger en grund för att använda molekylära chaperoner för att stabilisera MR1-molekyler och för att möjliggöra laddning och presentation av antigener direkt på cellytan", säger Nikolaos G. Sgourakis, Ph.D., docent vid Center for Computational and Genomic Medicine vid Children's Hospital of Philadelphia och senior författare till studien. "Framtida forskning bör screena bibliotek av metaboliter för att se vilka som visar hög affinitet för bindning till MR1. Forskare kan sedan överväga sätt att öka MR1-ytexpression, potentiellt genom att främja mer stabila MR1/chaperone-interaktioner via flera tillvägagångssätt, såsom användning av små molekyler ." + Utforska vidare