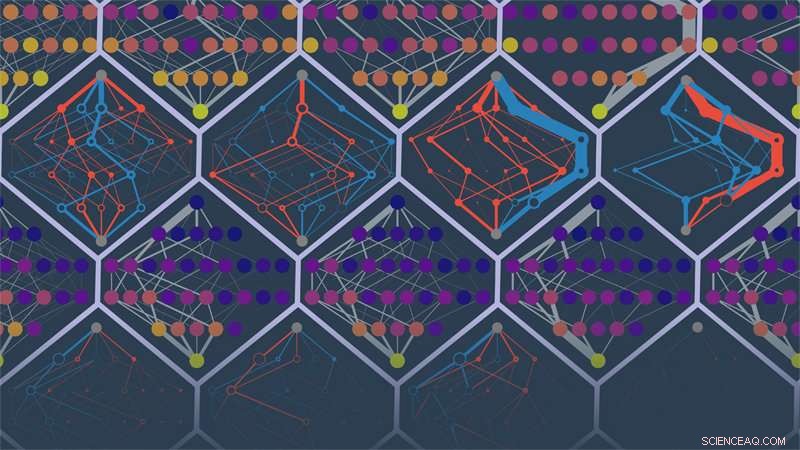
Forskare vid University of Oregons labb av Michael Harms förutspådde evolutionära vägar för olika simulerade proteiner. Punkterna i bilden är proteinsekvenser. Kanterna anger sannolikheter för banor. Färger anger låg till hög kondition (lila till gul) eller falskt otillgängliga eller falskt tillgängliga vägar (röd och blå). Kredit:Michael Harms och Zach Sailer
University of Oregon forskare teoretiserade att de kunde manipulera ett protein en mutation i taget och förutsäga dess utveckling. De försökte bevisa det. Och misslyckades.
De tänker, dock, att de har hittat en grundläggande sanning som ligger bakom oförutsägbarheten i ett biologiskt system. Grundläggande fysiska begränsningar gör osäkerhet till norm, de rapporterade i en tidning publicerad online 23 oktober i Proceedings of the National Academy of Sciences .
"Medan vi fick ett överraskande negativt resultat, vi kunde säga varför, " sa Michael J. Harms, professor vid UO:s institution för kemi och biokemi och forskare vid Institutet för molekylärbiologi. "Det är positivt. Vår enkla studie ger bekräftelse på vad många människor i fältet har observerat upprepade gånger - oförutsägbarhet. Det verkar vara universellt."
Forskningen var en digital angelägenhet, gjort med datorsimuleringar designade av UO doktoranden Zachary R. Sailer. Han och Harms skapade ett enkelt gitterprotein, med ett tillvägagångssätt som tidigare skapats i Harms lab, med en slumpmässig sekvens av 12 aminosyror. De körde sedan evolutionära simuleringar för att optimera stabiliteten, en fysisk egenskap hos proteinet.
Målet var att använda effekterna av alla 228 mutationer som man vet är associerade med startproteinet för att förutsäga dessa simulerade banor:vilken mutation skulle inträffa, när, över tid. Förmågan att projicera framåt försvann snabbt efter de två första mutationerna. Efter det, de förväntade banorna gick vilse bland ett växande antal sannolikheter för omdirigering.
"Kvaliteten på din information försämras faktiskt med tiden, Sailer sa. När mutationer ackumuleras, effekterna av mutationerna som du mätte börjar förändras så att du inte kan förutsäga vart du är på väg."
I deras papper, Sailer och Harms föreslår att fysik, speciellt termodynamik, är på spel. Varje mutation förändrar proteinet i en liten, men olinjärt sätt. Detta innebär att effekten av varje mutation beror på alla mutationer som inträffat tidigare.
"Jag tror att det vi visade, i grunden, är att även om du vet mycket om ett system, om ett protein, du kan inte förutsäga hur det utvecklas på grund av systemets fysik, " Sa Harms. "Det finns fysiska regler som begränsar evolutionen och dess förutsägbarhet."
Hur proteiner utvecklas är en grundläggande fråga inom evolutionsbiologin, ur både ett filosofiskt perspektiv, för att lära dig mer om maskineriet i biologiska system, och för ledtrådar som kan leda till förbättrade eller bättre droger.
"Praktiskt taget, Harms sa, "Vår forskning kan hjälpa oss att lära oss hur man förhindrar utvecklingen av antibiotikaresistens hos bakterier." Nästan alla bakterieburna infektioner utvecklar resistens mot antibiotika, skapa ett ledande folkhälsoproblem runt om i världen.
"Istället för att studera effekterna av alla individuella mutationer, " Sailer tillade, "kanske borde vi studera slumpmässiga kombinationer av många mutationer. Ett sådant tillvägagångssätt kan hjälpa oss att förutsäga utvecklingen av resistens."
Arbete pågår i Harms lab för att testa denna möjlighet på riktiga proteiner. "Vi bygger beräkningsverktyg som låter oss analysera datauppsättningar för antibiotikaresistens, och vi får tips om att ett kombinatoriskt tillvägagångssätt fungerar, " Sa Harms. "Det är mer komplicerat än att studera individuella mutationer, men vårt arbete visar att det är osannolikt att det individuella tillvägagångssättet kommer att fungera."