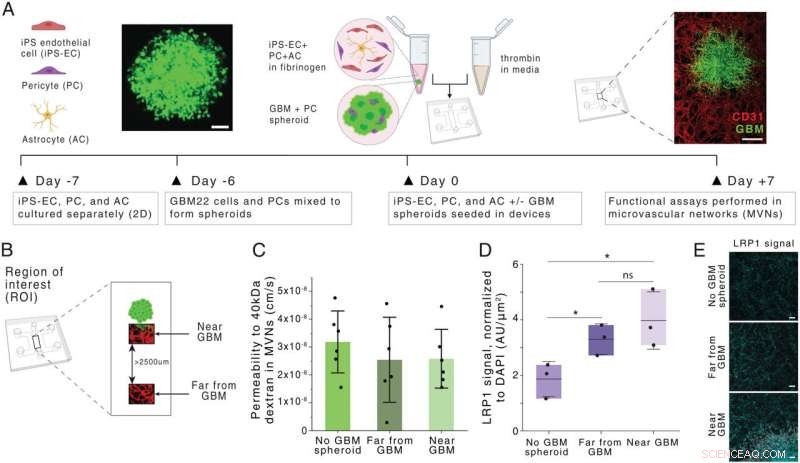
Generering och karakterisering av en glioblastom BBB MVN-modell (BBB-GBM-modell). (A) Schematisk av BBB-GBM-bildning i en mikrofluidisk enhet. (Skalstaplar:100 µm [vänster] och 500 µm [höger].) (B) ROIs identifierade rumsligt inom BBB-GBM-modellen, med långt ifrån GBM ROI identifierade att vara minst 2 500 µm från GBM-sfäroiden. (C) Permeabilitet för 40-kDa dextran i de vaskulära nätverken över olika ROI-platser; varje punkt representerar n =1 enhet. (D) Expression av LRP1 över olika ROI-platser, bedömd via immunfluorescensfärgning; varje punkt representerar n =1 enhet. (E) Representativa mikrofotografier av LRP1-färgning kvantifierade i D. (Skalstaplar:100 µm.) I alla grafer representerar staplarna medelvärde ± SD. ns, inte signifikant. *P <0,05. Statistiska analyser beskrivs i Material och metoder. AU, godtyckliga enheter; 2D, tvådimensionell. Kredit:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2118697119
Det finns för närvarande få bra behandlingsalternativ för glioblastom, en aggressiv typ av hjärncancer med hög dödlighet. En anledning till att sjukdomen är så svår att behandla är att de flesta cytostatika inte kan penetrera blodkärlen som omger hjärnan.
Ett team av MIT-forskare utvecklar nu läkemedelsbärande nanopartiklar som verkar komma in i hjärnan mer effektivt än läkemedel som ges på egen hand. Med hjälp av en mänsklig vävnadsmodell de designade, som exakt replikerar blod-hjärnbarriären, visade forskarna att partiklarna kunde komma in i tumörer och döda glioblastomceller.
Många potentiella glioblastombehandlingar har visat framgång i djurmodeller men har sedan misslyckats i kliniska prövningar. Detta tyder på att en bättre typ av modellering behövs, säger Joelle Straehla, Charles W. och Jennifer C. Johnson Clinical Investigator vid MIT:s Koch Institute for Integrative Cancer Research, en instruktör vid Harvard Medical School och en pediatrisk onkolog vid Dana-Farber Cancerinstitutet.
"Vi hoppas att genom att testa dessa nanopartiklar i en mycket mer realistisk modell kan vi skära ut mycket av den tid och energi som går till spillo på att prova saker på kliniken som inte fungerar", säger hon. "Tyvärr, för denna typ av hjärntumör, har det gjorts hundratals försök som har haft negativa resultat."
Straehla och Cynthia Hajal, postdoc vid Dana-Farber, är huvudförfattarna till studien, som visas denna vecka i Proceedings of the National Academy of Sciences . Paula Hammond, professor vid MIT-institutet, chef för avdelningen för kemiteknik och medlem av Koch-institutet; och Roger Kamm, Cecil och Ida Greens framstående professor i biologisk och mekanisk teknik, är seniorförfattarna till uppsatsen.
Modellering av blod-hjärnbarriären
För flera år sedan började Kamms labb arbeta med en mikrofluidisk modell av hjärnan och blodkärlen som utgör blod-hjärnbarriären.
Eftersom hjärnan är ett så vitalt organ är blodkärlen som omger hjärnan mycket mer restriktiva än andra blodkärl i kroppen för att hålla ute potentiellt skadliga molekyler.
För att efterlikna den strukturen i en vävnadsmodell odlade forskarna patienthärledda glioblastomceller i en mikrofluidisk enhet. Sedan använde de mänskliga endotelceller för att odla blodkärl i små rör som omger tumörcellernas sfär. Modellen inkluderar också pericyter och astrocyter, två celltyper som är involverade i transport av molekyler över blod-hjärnbarriären.
Medan Hajal arbetade på den här modellen som doktorand i Kamms labb, fick hon kontakt med Straehla, då en postdoc i Hammonds labb, som var intresserad av att hitta nya sätt att modellera nanopartikelläkemedelsleverans till hjärnan. Att få läkemedel över blod-hjärnbarriären är avgörande för att förbättra behandlingen av glioblastom, som vanligtvis behandlas med en kombination av kirurgi, strålning och oral kemoterapi temozolomid. Femårsöverlevnaden för sjukdomen är mindre än 10 procent.
Hammonds labb var pionjärer med en teknik som kallas lager-för-lager montering, som de kan använda för att skapa ytfunktionaliserade nanopartiklar som bär droger i sin kärna. Partiklarna som forskarna utvecklade för denna studie är belagda med en peptid som heter AP2, som har visat sig i tidigare arbeten hjälpa nanopartiklar att ta sig igenom blod-hjärnbarriären. Men utan exakta modeller var det svårt att studera hur peptiderna hjälpte till med transport över blodkärl och in i tumörceller.
När forskarna levererade dessa nanopartiklar till vävnadsmodeller av både glioblastom och frisk hjärnvävnad fann de att partiklarna belagda med AP2-peptiden var mycket bättre på att penetrera kärlen som omger tumörerna. De visade också att transporten skedde på grund av bindning av en receptor som kallas LRP1, som är mer riklig nära tumörer än i normala hjärnkärl.
Forskarna fyllde sedan partiklarna med cisplatin, ett vanligt förekommande kemoterapiläkemedel. När dessa partiklar belades med målpeptiden kunde de effektivt döda glioblastomtumörceller i vävnadsmodellen. Men partiklar som inte hade peptiderna skadade de friska blodkärlen istället för att rikta in sig på tumörerna.
"Vi såg ökad celldöd i tumörer som behandlades med den peptidbelagda nanopartikeln jämfört med de nakna nanopartiklarna eller det fria läkemedlet. Dessa belagda partiklar visade mer specificitet för att döda tumören, jämfört med att döda allt på ett ospecifikt sätt", säger Hajal.
Effektivare partiklar
Forskarna försökte sedan leverera nanopartiklarna till möss, med hjälp av ett specialiserat kirurgiskt mikroskop för att spåra nanopartiklarna som rör sig genom hjärnan. De fann att partiklarnas förmåga att passera blod-hjärnbarriären var mycket lik vad de hade sett i sin mänskliga vävnadsmodell.
De visade också att belagda nanopartiklar som bär cisplatin kunde bromsa tumörtillväxt hos möss, men effekten var inte lika stark som vad de såg i vävnadsmodellen. Detta kan bero på att tumörerna var i ett mer avancerat stadium, säger forskarna. De hoppas nu kunna testa andra läkemedel, som bärs av en mängd olika nanopartiklar, för att se vilka som kan ha störst effekt. De planerar också att använda sin metod för att modellera andra typer av hjärntumörer.
"Detta är en modell som vi kan använda för att designa mer effektiva nanopartiklar," säger Straehla. "Vi har bara testat en typ av hjärntumör, men vi vill verkligen utöka och testa detta med många andra, särskilt sällsynta tumörer som är svåra att studera eftersom det kanske inte finns så många prover tillgängliga."
Forskarna beskrev metoden de använde för att skapa hjärnvävnadsmodellen i en nyligen genomförd Nature Protocols papper, så att andra labb också kan använda det. + Utforska vidare
Denna berättelse är återpublicerad med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.