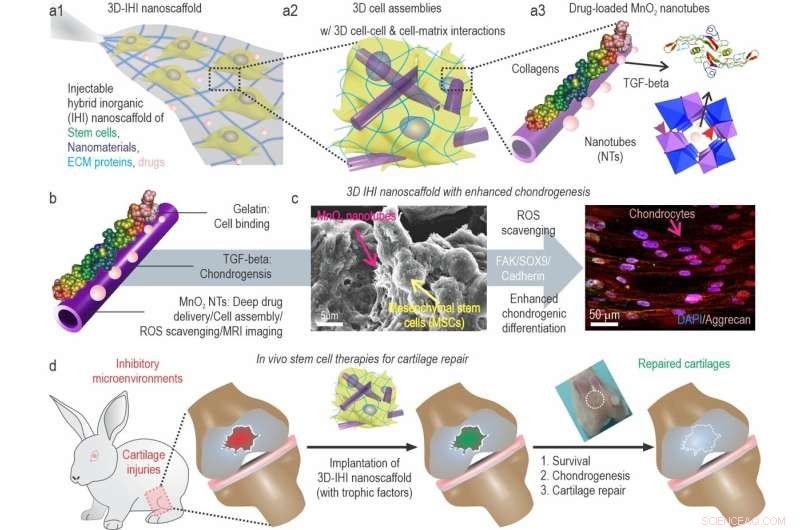
a) En schematisk illustration av 3D TGFβ-BMSC-IHI nanoställning. b) Den schematiska illustrationen av gelatinbelagd och TGF-β3-laddad MnO2 NTs. c) FESEM-bilden indikerade att de flesta av BMSCs bildar kontakter med andra celler och de 1D fibrillliknande strukturerna, vilket liknade strukturerna i naturliga vävnader. d) Genom att omforma den oxidativa mikromiljön, förbättra cellviabiliteten och kondrogenes av transplanterade celler, kunde broskregenerering slutligen uppnås. Kredit:Science China Press
En studie ledd av Prof. Qiuyu Zhang (Northwestern Polytechnical University), Prof. Ki-Bum Lee (Rutgers University) och Prof. Liang Kong (School of Stomatology, The Fourth Military Medical University) har etablerat en injicerbar hybrid oorganisk (IHI) nanoscaffold-mallrad stamcellssammansättning och använde den för att regenerera broskdefekter av kritisk storlek.
Broskskador är ofta förödande och de flesta av dem har inga botemedel på grund av den i sig självt låga regenereringsförmågan hos broskvävnader. Framväxten av 3D-stamcellsodlingssystem har lett till genombrott inom utvecklingsbiologi, sjukdomsmodellering och regenerativ medicin. Till exempel kan stamceller, när de väl har transplanterats framgångsrikt, initialt utsöndra trofiska faktorer för att minska inflammation vid ställen för broskskador och sedan differentiera till broskceller (t.ex. kondrocyter) för funktionell återställning.
Ändå finns det kritiska barriärer kvar att övervinna innan den terapeutiska potentialen hos stamcellsterapier kan realiseras. Den begränsade kontrollen över den kondrogena differentieringen av stamceller in vivo har ofta resulterat i försämrade regenerativa resultat. Dessutom, på grund av förekomsten av oxidativ stress och inflammation i mikromiljön på skadeställen, genomgår stamceller ofta apoptos efter injektion.
För att möta dessa utmaningar demonstrerade forskarna utvecklingen av ett 3D IHI nanoscaffold-mallat stamcellssammansättningssystem för avancerad 3D-stamcellsodling och -implantation. 3D-IHI nanoscaffold sätter snabbt ihop stamceller till injicerbara vävnadskonstruktioner genom skräddarsydda 3D-cell-cell- och cell-matris-interaktioner, levererar djupt och homogent kondrogena proteiner i de sammansatta 3D-odlingssystemen och inducerar kontrollerbart kondrogenes genom nanotopografiska effekter.
När det väl implanterats in vivo i en modell för kaninbroskskada, modulerar 3D-IHI nanoscaffold effektivt dynamisk mikromiljö efter broskskada genom integreringen av de tidigare nämnda regenerativa signalerna, och tar samtidigt bort reaktiva syrearter med hjälp av en mangandioxidbaserad komposition. På så sätt realiseras accelererad reparation av broskdefekter med snabb vävnadsrekonstruktion och funktionell återhämtning både på kort och lång sikt. Med tanke på den utmärkta mångsidigheten och det terapeutiska resultatet av 3D-IHI nanoställningsbaserad broskregenerering, kan det ge lovande medel för att främja en mängd olika vävnadstekniska tillämpningar.
Forskningen publicerades i National Science Review .
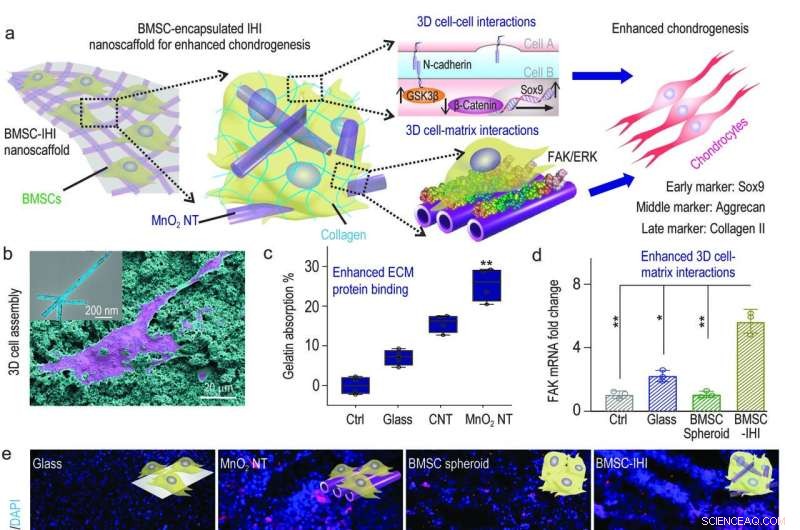
a) Ett schematiskt diagram som visar 3D-IHI nanoscaffold kan förbättra kondrogen differentiering av BMSC genom en synergi mellan N-cadherin och FAK-medierade vägar. b) Den starka interaktionen mellan MnO2 NTs och funktionella grupper som vanligtvis existerar i ECM-proteiner stödde effektivt cellvidhäftning, vilket visas via SEM-bild. c) Bicinchoninsyraanalys indikerade den förbättrade absorptionen mot gelatin från MnO2 nanotube compared to control groups. d) The MnO2 nanotube-templated assembly method significantly enhanced cell-matrix interaction as demonstrated through the up-regulated expression patterns of the FAK gene. e) Representative immunostaining images showing the improved chondrogenesis of BMSC in the BMSC-IHI nanoscaffold group compared to the control groups. Scale bar:50 μm. f-h) The expression of chondrogenic genes, including SOX9 (f), Aggrecan (g), and Col-II (h) were characterized via qRT-PCR measurement. Credit:Science China Press
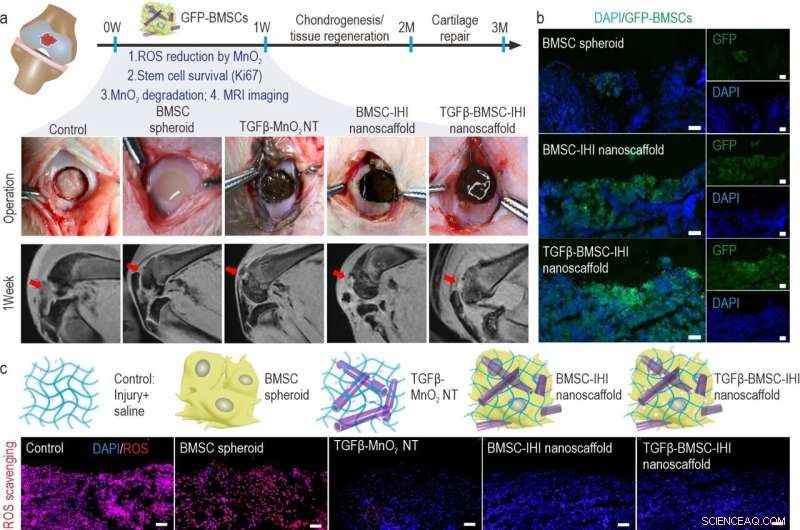
a) Schematic diagram illustrating the surgical process and timeline of cartilage repair. The degradation of MnO2 NTs and the regeneration process could be monitored via MRI. b) To identify our transplanted cells, BMSCs were genetically labeled with a green fluorescent protein (GFP). Scale bar:100 μm. c) The dramatically reduced red fluorescent signals of the ROS probe revealed that MnO2 NTs in the IHI nanoscaffold could effectively scavenge ROS in the defect area. Promoted cell proliferation was confirmed by the higher expression of proliferative marker Ki67 immunostaining. Scale bar:50 μm. d) The TGFβ-BMSC-IHI nanoscaffold could retain a significantly higher amount of cells after transplantation compared to other cell transplantation groups by quantifying the number of remaining GFP+ cells in (c). e) Histogram of the fluorescence intensity of ROS probe showed the effective consumption of ROS in the MnO2 NTs containing groups. f) Quantification of Ki67+ cells in the defects. The quantifications in (e) and (f) were generated based on the fluorescence intensities in (c). Credit:Science China Press
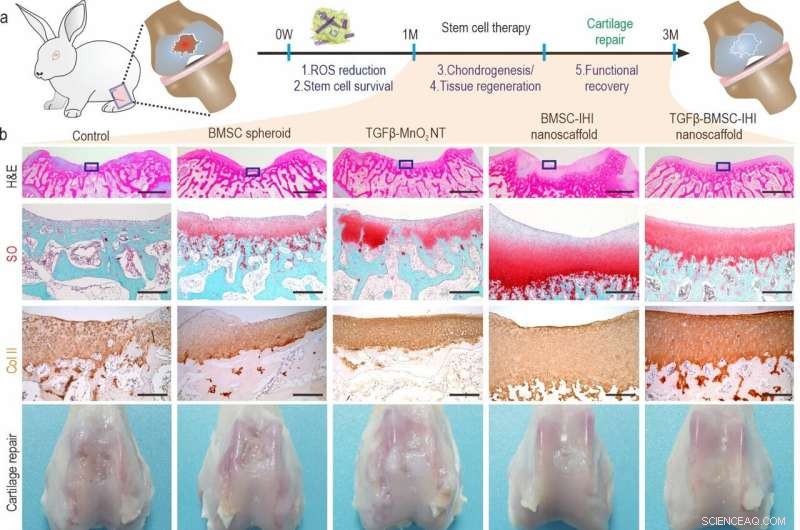
a) A schematic diagram illustrating the long-term (3 months) cartilage regeneration process. b) The in vivo cartilage regeneration was characterized through H&E, Safranin O staining, Col-II immunochemistry staining, as well as macroscopic views. Zoom out scale bar:2 mm, zoom in scale bar:200 μm. c-h) Quantifications of cartilage thickness (by H&E staining) (c), cellular components (by Safranin O staining) (d), ECM components (by Col II immunostaining) (e). Results of International Cartilage Repair Society (ICRS) macroscopic (f) and histologic scores (g) indicated significantly improved defect repair qualities in the TGFβ-BMSC-IHI nanoscaffold group. The reduced Osteoarthritis Research Society International (OARSI) scores revealed the TGFβ-BMSC-IHI nanoscaffold could prevent the deterioration of osteoarthritis (h). Credit:Science China Press