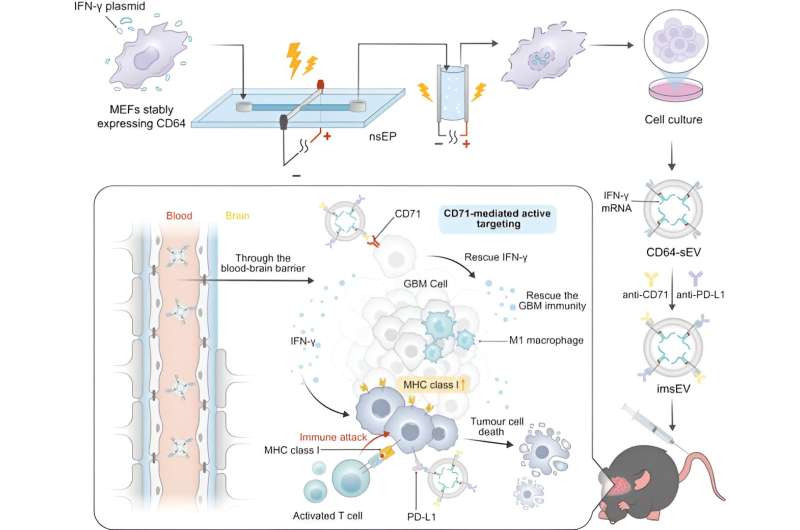
Ett team av forskare vid University of Texas MD Anderson Cancer Center har utvecklat en ny metod för att använda extracellulära vesiklar för att förbättra svaren på immunterapi vid glioblastom, vilket potentiellt öppnar dörren för bredare användning av manipulerat budbärar-RNA (mRNA) för cancerterapi. Studien publicerades idag i Nature Communications.
Tidigare i år utvecklade ett team av forskare under ledning av Betty Kim, M.D., Ph.D. och Wen Jiang, M.D., Ph.D., en ny metod för att ladda mRNA i extracellulära vesiklar, små strukturer skapade av celler för att transportera biomolekyler och nukleinsyror i kroppen. Den aktuella studien bygger på den forskningen genom att demonstrera antitumörpotentialen hos mRNA-laddade extracellulära vesiklar.
mRNA-terapier, som erkändes av 2023 års Nobelpris i fysiologi eller medicin, har länge haft genombrottspotential inom patogena infektioner såväl som sjukdomar som cancer. Men utmaningarna kvarstår för att korrekt leverera mRNA i hela kroppen. I åratal har forskare studerat potentiella leveransmekanismer, inklusive lipider eller polymera nanopartiklar, men var och en av dessa har sina egna begränsningar.
"Det finns två primära utmaningar med att använda mRNA-terapier för cancerbehandling. För det första, hur riktar man sig exakt mot tumörcellerna i kroppen? För det andra, hur producerar man tillräckligt med terapi för mänskligt bruk?" sa Jiang. "Vårt tillvägagångssätt löser de två problemen."
Kvantitetsproblemet löses genom att använda ett system med hög genomströmning för att producera mRNA-laddade extracellulära vesiklar från konstruerade celler. Värdceller och en designerplasmid som kodar för mRNA:t utsätts för två extremt korta elektriska pulser, vilket gör att membran inuti cellen, såväl som själva cellmembranet, blir tillfälligt permeabla. Detta leder till att cellerna utsöndrar många extracellulära vesiklar laddade med mRNA-material som sedan kan samlas upp.
För denna studie konstruerade forskarna de extracellulära vesiklarna för att uttrycka CD64-proteinet på deras yta, vilket fungerar som en dockningsmekanism för att ladda både anti-CD71- och anti-PD-L1-antikroppar. Väl i kroppen söker de upp CD71 och PD-L1, som båda ofta överuttrycks i glioblastom.
Dessa extracellulära vesiklar laddades med mRNA som kodar för interferon-gamma, ett immunsignalprotein. När vesiklarna binder till receptorer på tumörceller internaliseras de och frisätter mRNA.
En anledning till att glioblastom är svårt att behandla är att nedregleringen av MHC-1, liksom andra egenskaper hos tumörens mikromiljö, skapar en immunsuppressiv miljö som undviker upptäckt och begränsar effektiviteten av immunterapier. mRNA:t vänder på det och ändrar tumörens mikromiljö för att göra tumören detekterbar för immunsystemet och mer känslig för immunterapier. I de prekliniska modellerna observerades en signifikant ökning av överlevnadstid och initial antitumöraktivitet inom 7 dagar efter injektion.
"Vi valde glioblastom eftersom det har begränsade behandlingsalternativ för närvarande," sade Jiang. "Vi vet att interferon-gamma kan inducera svar på immunterapi vid glioblastom, men att leverera det till tumörcellerna har hittills visat sig vara en stor utmaning på grund av dess halveringstid och oförmågan för de flesta leveranssystem att passera blod-hjärnan Dessa resultat banar förhoppningsvis vägen för mRNA-laddade extracellulära vesiklar att användas i cancerapplikationer."
Enligt Jiang är en av de andra fördelarna med detta tillvägagångssätt att det är plug-and-play, vilket innebär att det kan anpassas till andra tumörer genom att helt enkelt ändra antikropparna för att rikta in sig på de som överuttrycks i andra tumörtyper.
Ytterligare prekliniskt arbete pågår för att fortsätta att förbättra produktionsmetoderna och profilera säkerheten för extracellulära vesiklar innan de appliceras i kliniska miljöer.
Mer information: Shiyan Dong et al, Adaptiv design av mRNA-laddade extracellulära vesiklar för riktad immunterapi av cancer, Nature Communications (2023). DOI:10.1038/s41467-023-42365-5
Journalinformation: Nature Communications
Tillhandahålls av University of Texas M. D. Anderson Cancer Center