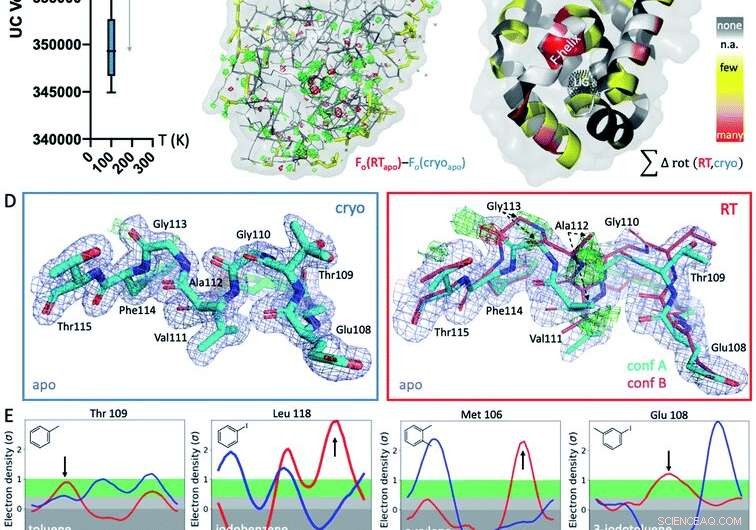
Fig. 1 Globala och lokala strukturella svar på temperaturen. (A) Globalt, strukturer vid kryogena temperaturer (cryo; blå plot) är mer variabla och mer kompakta än deras rumstemperatur (RT; röda plot) ekvivalenter, som visas av genomsnittliga enhetscells (UC) volymer över 9 matchade strukturer som samlats in vid båda temperaturerna. (B) Den isomorfa Fo - Fo -kartan över apo -strukturen som samlats in vid kryo kontra RT visar skillnader i elektrontätheten (grönt nät, positiv skillnad elektrontäthet; rött nät, negativ skillnad elektrontäthet) som indikerar särpräglade temperatureffekter, särskilt runt det ligandbindande stället i bottenloben, indikeras av det svarta prickade nätet i panel C (märkt LIG). (C) Förekomst av temperaturberoende rotamerskillnader över alla 9 strukturerna projiceras på respektive rester i T4L apo-strukturen; färgad av temperaturkänslighet för varje rest över alla 9 strukturpar:gul för få strukturer, orange för flera strukturer, och röd för de flesta strukturer som visar temperaturskillnader för återstoden; vita fläckar är Gly och Ala som inte har Chi -vinklar; och grå fläckar visar ingen rotamerändring med temperaturen. (D) Lokalt, RT-data för L99A apo-kaviteten avslöjar en alternativ F-helix-konformation (konf. B) i Fo-Fc-skillnadens elektrontäthetskartor (grönt och rött nät för positiv och negativ densitet, respektive; endast cyanformation A ingick i förfining) som inte syns vid kryo; 2mFo - DFc -karta visas som blått nät; sticktjocklek representerar relativ beläggning. (E) Alla 8 ligandkomplexen visar en förskjutning i föredragen orientering som svar på temperaturen snarare än på grund av ligandbindning för minst 1 restrotamer i F-helixen nära ligandbindningsstället. Ringsignaler för utvalda rester, med rotamerskillnader vid RT (röd) kontra kryo (blå) indikerade med pilar. Kredit:DOI:10.1039/D1SC02751D
Omkring 95% av alla kristallstrukturer erhållna för olika proteiner och deponerade i offentliga databaser fångas med kryogen teknik. Denna teknik kräver frysta förhållanden. Forskare vid St. Jude Children's Research Hospital jämförde kryogena strukturer med de som observerades vid rumstemperatur. Resultaten, publicerad idag i Kemisk vetenskap , ange att frysning kan ge fel, orsaka att vissa konformationer (former) missas och leder till felaktigheter i beräkningsmodeller.
Proteinstrukturer är viktiga för läkemedelsutvecklingsprocessen eftersom de ger en karta över hur riktade läkemedel ska utformas.
"Vi måste tänka om hur vi samlar in, analysera och använda strukturell information när vi bestämmer oss för att upptäcka bioaktiva molekyler, "sade motsvarande författare Marcus Fischer, Ph.D., St. Jude Institutionen för kemisk biologi och terapi. "Du kan se temperaturen som en experimentell vred vi kan vrida för att utforska dolda proteinkonformationer."
Temperaturen gör hela skillnaden
Forskarna har visat att frysning förvränger de konformationer som proteiner tar, introducerar ofta fel i strukturer. Teamet fann också att vissa konformationer som uppstår vid rumstemperaturförhållanden kan missas om man bara tittar på resultaten från kryogena tekniker.
Forskarna genomförde en systematisk utvärdering av kryogena strukturer, börjar med T4 -lysozym L99A -kaviteten. Detta protein anses vara en "arbetshäst" i strukturbiologi för att förstå proteinstabilitet, styvhet och ligandbindande termodynamik. Växling till rumstemperatur avslöjade nya strukturförändringar som har missats i årtionden.
Teamet testade ytterligare fyra proteinklasser. Resultaten gällde oavsett vilken typ av protein som utvärderades.
"När du går ut på vintern och är kall, du komprimerar och krymper in på dig själv, och i solen när du är varm sträcker du ut dig. Proteiner gör detsamma, "Sa Fischer.
undvika fel
Beräkningsmetoder är algoritmer som forskare använder för att göra förutsägelser eller utvärdera data som erhållits från deras experiment. Resultaten indikerar att när dessa metoder bygger på data från kryogena strukturer, fel kan införas som kan skada framtida resultat.
Kryogena tekniker har länge gynnats eftersom de gör det lättare att få strukturerna. Att få strukturer i rumstemperatur är tråkigare. Även om det finns sätt att mildra dessa problem, faktorer som datafullständighet och strålskador är ytterligare hinder för många forskare när det gäller att få rumstemperaturstrukturer.
Medan detektering av en dold proteinform är informativ, som visar den nya formens inverkan på protokoll för upptäckt av läkemedel saknades fortfarande.
"Vi såg att proteinet antog ett tillstånd för att interagera med ligander, och att saknad information kan hjälpa till att förbättra noggrannheten i virtuella läkemedelsscreening och protein-ligand-interaktionssimuleringar, "sa den första författaren Shanshan Bradford, Ph.D., St. Jude Institutionen för kemisk biologi och terapi.
Forskarna understryker att när man bara överväger kryogena strukturer, det finns inget sätt att säga om det finns fel, men den jämförelsen med rumstemperaturstrukturer kan hjälpa till att klargöra information och eventuellt avslöja ytterligare insikter som annars missas.