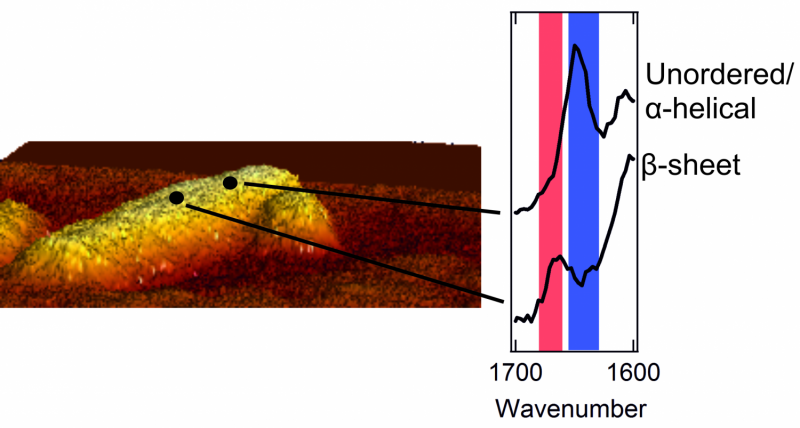
Till vänster:en atomkraftmikroskopbild av en fibrill med en diameter på några nanometer. Höger:två spektra som visar den yttre strukturen. En topp i det röda området är karakteristiskt för en lapp med en prydligt ordnad betaarkstruktur. En topp i det blå området är typiskt för ett område med kaotiska, rörig struktur.
Forskare från FOM-institutet AMOLF har, för första gången någonsin, lyckats göra en bild av den yttre strukturen av ett proteinaggregat som orsakar sjukdomar som Alzheimer och typ-2 diabetes. De upptäckte att den yttre ytan på dessa aggregat är strukturerad på ett mycket rörigt sätt - mycket till skillnad från deras prydligt arrangerade interiörer. Forskarna hoppas att deras arbete kommer att ge mer insikt i hur aggregaten skadar närliggande celler. Forskningsresultaten publicerades online i tidskriften Små den 7 maj, 2015.
Proteinaggregaten som studerats av forskarna består av långa, vikta proteiner. Forskare har varit bekanta med den inre strukturen hos dessa aggregat (formellt kända som amyloidfibriller) under ganska lång tid. Dock, med konventionella mikroskop förblev det alltid omöjligt att se proteinstrukturerna på utsidan av aggregaten. I efterhand, det var som om forskarna var inlåsta i ett hus. De kunde noggrant studera husets inre, men så länge de inte hade nyckeln, de kunde inte kliva ut och titta på dess fasad på utsidan. Genombrottet kom när forskarna tog fram den "nyckeln" genom att kombinera två olika tekniker:mikroskopi och spektroskopi. Detta gjorde det möjligt för dem att äntligen studera det yttre "tegelverket".
Rörig
När de väl kunde få en glimt av utsidan av proteinaggregaten, forskarna fick en överraskning. Det inre av aggregaten är strikt organiserat. Proteinerna är snyggt ordnade i en så kallad beta-arkstruktur, som bildar en vriden, veckat ark. Dock, de fann att utsidan av aggregatet har en mycket stökigare och kaotiskare struktur. Det är, de yttre proteinerna bildar en oorganiserad, oregelbundet mönster. Här och där, det finns lappar som bildar en betaarkstruktur, men på andra ställen är denna regelbundenhet ingenstans att finna. Forskarna fann till och med strukturella skillnader från en nanometer till nästa, på en och samma fibrill.
Forskarna märkte också att varje fibrils yttre struktur skiljer sig mycket från nästa. En fibrill kan innehålla många plåster med en beta-arkstruktur, medan en annan saknar dessa vanliga plåster nästan helt. Dessutom, aminosyrorna som kan hittas på utsidan skiljer sig också för varje fibrill.
Det röriga yttre är i direkt kontakt med membranen hos närliggande celler. På det här sättet, dess struktur spelar en avgörande roll för att skada dessa celler. Denna typ av cellskada är vanligt förekommande hos patienter med typ 2-diabetes eller Alzheimers sjukdom.
"Nyckeln" som öppnade dörrarna
AMOLF-forskarna samarbetade med sina kollegor vid Utrecht University, Max Planck Institute for Polymer Research i Mainz, och Leibniz Institute for Photonic Technology i Jena för att utveckla ett nytt sätt att se aggregatens exteriörs proteinstruktur. Nyckeln visade sig vara en kombination av spektroskopi och atomkraftsmikroskopi.
Ett atomkraftmikroskop består av en vass spets (sond) som rör sig över ett föremåls yta. Detta gör att mikroskopet kan utforska en amyloidfibrill i atomär skala och göra en reliefkarta. Under tiden, spektrometern mäter det så kallade Raman-spektrumet för varje pixel på kartan. Dessa spektra ger information om hur proteinerna viks, och närvaron av specifika aminosyror på aggregatens yta. Signalerna som mäts av spektrometern är vanligtvis svaga, men ett metalliskt lager på spetsen av mikroskopet förstärker dem kraftigt.
Bilder av amyloidfibrillernas yttre hade gjorts tidigare, men teamet avbildade nu också hur proteinerna veks. Första författare Corianne van den Akker:"Genom att kombinera mikroskopi och spektroskopi, vi lyckades länka varje bit av strukturen till en plats på amyloidens utsida. På det här sättet, vi skulle kunna göra en bild med nanoskalaupplösning, samt bestämma strukturen på varje plats. Det är den unika bedriften med tekniken vi använde."
Nästa steg
Med den nyvunna kunskapen, det kommer att vara möjligt att mäta strukturen hos amyloider som har bildats på utsidan av levande celler också. Tekniken kan också användas för att testa medicin som syftar till att förebygga eller lösa upp proteinaggregat.