
Varje proteinsubenhet har olika färg. V1-domänen är toppen, Vo botten, perifera stjälkar vänster och höger. Bakgrunden visar vinddriven vattenpump. Kredit:IST Österrike, 2019
Celler är beroende av proteinkomplex som kallas ATP-syntaser eller ATPaser för deras energibehov. Adenosintrifosfat (ATP) molekyler driver de flesta av de processer som upprätthåller liv. Strukturbiolog professor Leonid Sazanov och hans forskargrupp från Institute of Science and Technology Austria (IST Austria) i Klosterneuburg, Österrike har nu bestämt den första atomstrukturen för representanten för V/A-ATPase-familjen, fylla i luckan i det evolutionära trädet för dessa viktiga molekylära maskiner. Dessa resultat erhållna med de senaste kryo-elektronmikroskopimetoderna avslöjade en turbin- eller vattenkvarn liknande struktur av enzymet och har nu publicerats i tidskriften Vetenskap .
Roterande kraft
ATP-syntaser/ATPaser är stora membranproteinkomplex som delar övergripande bruttobyggnadsplaner och roterande katalysmekanismer. Denna proteinfamilj inkluderar enzym av F-typ som finns i mitokondrier (cellens kraftfabriker), kloroplaster (organeller som utför fotosyntes i växter) och bakterier; V (vakuolär)-typ som finns i intracellulära avdelningar i eukaryoter (högre organismer med en kärna) och A (arkeal)-typ som finns i prokaryoter - arkaer (urgamla mikroorganismer) och vissa bakterier.
Olika smaker av ATPaser
Enzymer av F- och A-typ fungerar vanligtvis för att producera ATP, drivs av protonflöde över membranet. Enzymer av V-typ fungerar vanligtvis omvänt, använder ATP för att pumpa protoner. V- och A-ATPaser är strukturellt lika men de skiljer sig från F-typen genom att ha två eller tre perifera stjälkar och ytterligare anslutande proteinsubenheter mellan V1 och Vo. Enzymer av V-typ har troligen utvecklats från A-typ och på grund av dessa likheter kallas A-typ också för V/A-ATPas. Vissa bakterier, Inklusive Thermus thermophilus , förvärvat ett enzym av A-typ. Long Zhou, postdoc i Sazanov forskargruppen vid IST Österrike, har renat och studerat detta enzym (ThV1Vo) med cryo-EM. I motsats till F-typ, för ATPaser av V-typ bestämdes endast strukturerna för de isolerade V1- och Vo-domänerna tidigare. Hur V1 är kopplad till Vo var därför inte känt, och kunskapen om den fullständiga katalytiska cykeln saknades.
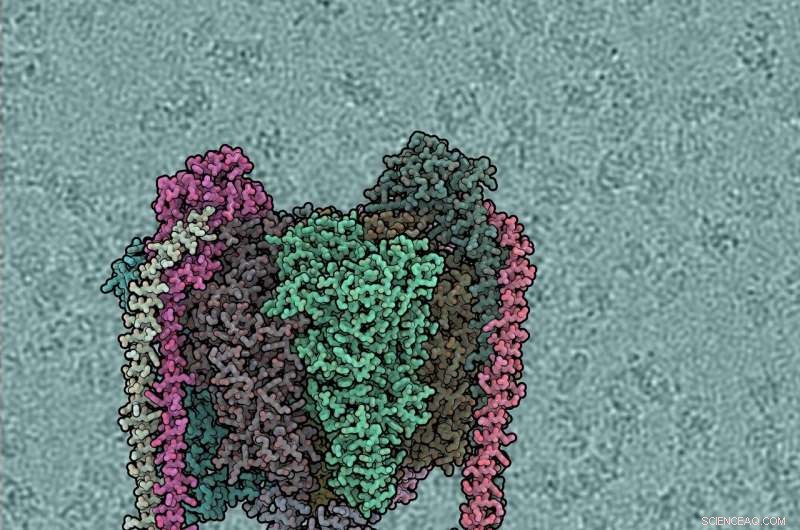
Varje proteinsubenhet har olika färg. V1-domänen är toppen, Vo botten, perifera stjälkar vänster och höger. Bakgrunden visar rå kryo-EM mikrofotografi, med individuella ATPas-molekyler synliga. Kredit:IST Österrike, 2019
Plasticitet och konkurrens
Forskarna fastställde inte en, men totalt fem strukturer av hela ThV1Vo-enzymet, med användning av kryo-elektronmikroskopimetoder som nyligen utvecklats i den så kallade "upplösningsrevolutionen" av denna teknik. Strukturerna representerar flera konformationstillstånd hos enzymet som skiljer sig åt genom positionen av rotorn inuti statorn. Global konformationsplasticitet hos ThV1Vo avslöjas som en betydande V1 som vacklar i rymden i övergången från ett tillstånd till ett annat. Det är ett resultat av mekanisk konkurrens mellan rotation av den böjda centrala rotorn och statorns styvhet. V1-Vo-koppling uppnås via nära strukturell och elektrostatisk matchning mellan axeln och V-typspecifik underenhet som länkar den till c-ringen. Visualiseringen av protonbanan avslöjade signifikanta skillnader i fördelningen av laddade proteinrester från den i F-ATPaser, med en striktare "kontrollpunkt" som förhindrar "glidning" av enzymet.
Varför ytterligare komplexitet?
Istället för en enda perifer stjälk av enzymer av F-typ, A-typer som ThV1Vo har två perifera stjälkar, medan eukaryota V-typer har tre. Men vad är fördelen med den extra komplexiteten i den redan mycket stora proteinsammansättningen, tillsammans med ytterligare underenheter som länkar V1 och Vo? F1/V1-domänen har en trefaldig symmetri och så en ATP-molekyl produceras (eller konsumeras) för varje 120° rotation av statorn inuti F1/V1. Professor Leonid Sazanov säger:"I V/A-ATPases är detta steg en engångsrotation på 120°, i motsats till F-ATP-syntas där det är uppdelat i flera delsteg. Således, större plasticitet kan krävas i ThV1Vo för att länka dessa 120° steg i V1 till mindre per c subenhetssteg i Vo c12-ringen. Denna ytterligare flexibilitet kan ges i V-typer av de ytterligare perifera stjälkarna och anslutande subenheter. Våra nya strukturer visar hur detta uppnås, tillhandahåller ett ramverk för hela V-ATPase-familjen".