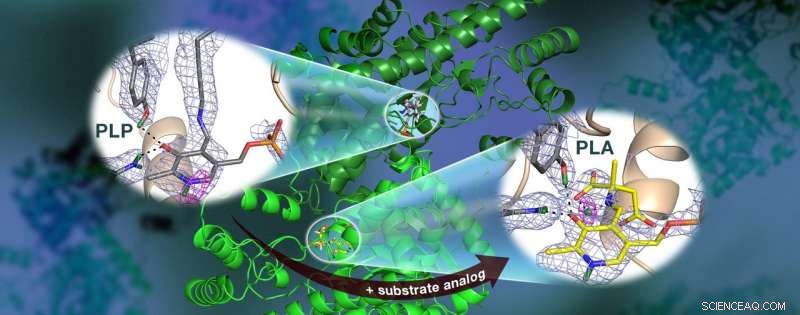
Ett ORNL-ledda team använde neutroner för att observera AAT-enzymet, ett vitamin B6-beroende protein, och fann att den kemiska reaktionen endast inträffade på ett aktivt ställe. Kärnspridningslängddensitetskartor (färgat nät) belyser positionerna för kritiska väteatomer, inklusive en lågbarriärvätebindning (magenta mesh) som inte tros existera i AAT, vilket kan vara avgörande för katalys. Kredit:Jill Hemman och Andrey Kovalevsky /Oak Ridge National Laboratory, USA:s energidepartement
Forskare vid Department of Energy's Oak Ridge National Laboratory har utfört neutronstrukturanalys av ett vitamin B6-beroende protein, potentiellt öppna vägar för nya antibiotika och läkemedel för att bekämpa sjukdomar som läkemedelsresistent tuberkulos, malaria och diabetes.
Specifikt, laget använde neutronkristallografi för att studera lokaliseringen av väteatomer i aspartataminotransferas, eller AAT, ett enzym som är avgörande för metabolismen av vissa aminosyror.
"Vi visualiserade den första neutronstrukturen av ett vitamin B6-enzym som tillhör en stor proteinfamilj med hundratals medlemmar som finns i naturen, " sa ORNLs Andrey Kovalevsky, en senior medförfattare till studien, som publicerades i Nature Communications.
Vitamin B6-beroende proteiner är en del av en mångfaldig grupp enzymer som utför över hundra olika kemiska reaktioner i celler. Enzymerna är av intresse för biomedicinska, samt bioenergi, forskare på grund av deras roll i att metabolisera aminosyror och andra cellnäringsämnen.
"Dessa enzymer är unika genom att var och en utför en specifik kemisk reaktion med utsökt noggrannhet, samtidigt som de undertrycker andra livskraftiga kemiska omvandlingar, " sade Kovalevsky. "Hur de åstadkommer detta är inte väl förstått, men det är av stor betydelse för läkemedelsdesign."
Teamets tidigare forskning förutspådde att väteatomer rör sig i och runt enzymets aktiva plats, där den kemiska reaktionen äger rum, indikerar att väteatomernas placering styr reaktionstypen. Att känna till den exakta platsen för väteatomer kan förklara varför dessa enzymers beteende är så specifikt, men väte är svårt att upptäcka med standardmetoder som röntgenkristallografi.
För att direkt bestämma positionerna för väteatomer inom AAT, det ORNL-ledda teamet vände sig till neutrondiffraktionstekniker. Forskarna exponerade känsliga proteinkristaller för neutroner med hjälp av IMAGINE-strållinjen vid ORNLs högflödesisotopreaktor och LADI-III-strållinjen vid Institut Laue-Langevin i Grenoble, Frankrike.
Förvånande, teamet observerade en reaktion inom en AAT-proteinbiomolekyl medan en annan AAT-biomolekyl var oförändrad, ger ett före- och efterperspektiv på den enzymkatalyserade kemiska reaktionen.

ORNLs Steven Dajnowicz (vänster) och Andrey Kovalevsky förberedde ett prov för att påbörja neutronstrukturanalys av ett vitamin B6-beroende protein med hjälp av IMAGINE-strållinjen vid ORNL:s högflödesisotopreaktor. Resultaten av studien kan öppna vägar för nya antibiotika och läkemedel för att bekämpa sjukdomar. Kredit:Genevieve Martin/Oak Ridge National Laboratory, USA:s energidepartement
"Datan avslöjade att i en av enzymets biomolekylära strukturer omorganiserades de kovalenta bindningarna efter att en kemisk reaktion inträffade i det aktiva stället och, i en annan, reaktionen hade inte ägt rum, " sade Kovalevsky. "I huvudsak, vi kunde få två strukturer i en kristall, vilket aldrig tidigare har gjorts för något protein som använder neutroner."
Med denna kunskap, teamet kommer att köra molekylära simuleringar för att bestämma väteatomernas specifika beteende när de interagerar med enzymet. Resultaten kan vara användbara för att vägleda den framtida utformningen av nya läkemedel mot multiresistent tuberkulos, malaria, diabetes och antibiotikaresistenta bakterier.
"Denna studie belyser hur neutroner är en oöverträffad sond för att identifiera lokaliseringen av väteatomer i biologiska system, ger oss en aldrig tidigare skådad nivå av strukturella detaljer för detta viktiga enzym, ", sa LADI-III strållinjeforskaren Matthew Blakeley.