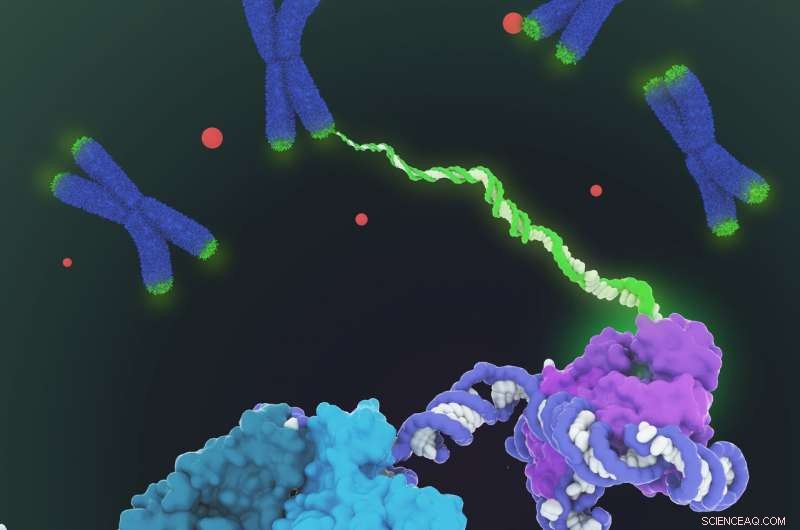
Visad är den rymdfyllande modellen av human telomerasholoenzymstruktur bestämd med kryo-elektronmikroskopi (kryo-EM). Telomeras katalyserar syntesen av telomert DNA (grönt) i kromosomändarna (blått) för att kompensera för förlusten av telomerer under genomreplikation. Strukturen består av två lober med distinkta funktionaliteter:den katalytiska kärnan (lila) som ansvarar för DNA-syntesen och en H/ACA-ribonukleoproteinlob (cyan, kricka och ljusgrön) viktiga för telomerasbiogenes och lokalisering till Cajal-kroppen (röda prickar och nedre vänstra i närbild). Med tanke på att telomerasreglering är inblandad i cancer och åldrande, denna första arkitektoniska visualisering av humant telomeras representerar ett viktigt genombrott inom telomerasområdet och telomerasbaserad terapeutisk design. Kredit:Janet Iwasa
För mer än 30 år sedan, när University of California, Berkeley-forskare upptäckte telomeras - ett enzym som förlänger kromosomändarna och hindrar dem från att fransa tillräckligt för att döda en cell - spekulationerna gick vilt om dess roll i åldrande och cancer, starta en helrättspress för att producera droger för att aktivera eller blockera enzymet.
Medan varken telomerasbaserade anti-aging läkemedel, utropad som en "ungdomskälla, "inte heller anticancerläkemedel har ännu dykt upp, publiceringen i dag av UC Berkeleys forskare av den första detaljerade bilden av molekylstrukturen hos mänskligt telomeras borde sätta fart på det arbetet, möjliggöra mer riktade läkemedelsscreeningar och intelligent design av nya läkemedel.
"Det har gått länge. Det tog mycket uthållighet, sa Kathleen Collins, en professor i molekylär- och cellbiologi från UC Berkeley som har arbetat med enzymet i 26 år.
Collins och Eva Nogales, också professor i molekylär- och cellbiologi, är seniorförfattarna till en artikel som beskriver 3D-molekylstrukturen hos det mänskliga telomerasenzymet som publicerades denna vecka i tidskriften Natur .
En flaskhals har varit att få rena prover av denna komplexa molekyl, som är sammansatt av en RNA-ryggrad dekorerad av sex typer av protein som rör sig när de lägger till DNA till ändarna av kromosomerna. Labs runt om i världen har diskuterat om enzymet fungerar ensamt eller som tvillingar, och hur och hur många proteiner dekorerar RNA -ryggraden.
Utan konsensus i dessa frågor, det har visat sig svårt att designa ett läkemedel för att rikta in sig på den molekylära maskinen och antingen förstöra telomerasaktivitet – vilket kan stoppa en cancer som har ökat dess telomerasnivåer – eller starta om telomeras, kanske för att förbereda kroppen för snabb celldelning efter en benmärgstransplantation.
Den nyligen avslöjade strukturen saknar fortfarande fina detaljer, men i kombination med kunskap om gensekvensen för humant telomeras, den ger tillräckligt med information för att börja tänka på potentiella mål för droger, sa förstaförfattaren Thi Hoang Duong "Kelly" Nguyen, en postdoktor vid Miller Institute vid UC Berkeley.
"De bästa tidigare bilderna av mänskligt telomeras hade en upplösning på endast 30 Ångström; vi kunde få cirka 7 till 8 Ångströms upplösning med hjälp av kryoelektronmikroskopi, " sa Kelly. "När jag kom till den punkt där jag kunde se alla underenheter – vi hade totalt 11 proteinsubenheter – var det ett ögonblick av, 'Wow, Wow, så här passar de alla ihop."
Nguyen, Collins och Nogales arbetar aktivt för att förbättra upplösningen till 3 eller 4 Ångström – ungefär lika stor som två kolatomer – vilket är tillräckligt för läkemedelsdesign.
Telomeras fyller på telomererna
Telomerer upptäcktes först på molekylär nivå i slutet av 1970 -talet av Elizabeth Blackburn, sedan vid UC Berkeley och nu president emerita för Salk Institute for Biological Studies i La Jolla, Kalifornien. Arbeta med den cilierade protozoen Tetrahymena, hon och kollegor visade att ändarna på kromosomerna täcks av upprepade DNA-sekvenser. Beväpnad med kunskap om telomersekvens, forskare visade sedan att telomerer i vävnader hos flercelliga organismer blir kortare varje gång en cell delar sig. Telomererna skyddar DNA-strängarna från att nötas och skadas i ändarna, ungefär som plastspetsen på änden av ett skosnöre. Det faktum att de faller av vid varje celldelning tros skydda oss från cancer, när en cell kapas och förökar sig kontinuerligt.
1985 vid UC Berkeley, Blackburn och dåvarande doktoranden Carol Greider upptäckte telomeras, ett enzym som tillför DNA till kromosomändarna, förlänger dem och förlänger cellens livslängd. Svart brännskada, Greider och en annan kollega, Jack Szosak, delade 2009 års Nobelpris i fysiologi eller medicin för upptäckten av telomeras.
Forskare har sedan dess funnit att hos människor och andra flercelliga organismer, telomeras uttrycks endast i embryot, inte i de flesta vuxna celler. Det betyder att de flesta celler vid födseln har en förutbestämd förmåga att växa och dela sig, varefter de dör. Många forskare tror att utarmade telomerer är en viktig orsak till åldrande.
Collins har försökt bestämma strukturen av telomeras ända sedan det första mänskliga telomerasproteinet upptäcktes 1997, och hon och hennes kollegor har upptäckt och utförligt karakteriserat många av proteinerna i det stora enzymet, såväl som den uppbrutna hårnålsstrukturen hos telomerasets RNA-ryggrad. Men hur de alla passade ihop var en gåta på grund av motstridiga resultat från många olika laboratorier.
Nguyen kunde isolera det aktiva enzymet och rena det mycket bättre än någon annan gjort tidigare, och anställde en ny, state-of-the-art kryoelektronmikroskop för att entydigt bestämma strukturen hos det aktiva telomeraset. Cryo-EM är en teknik för att bestämma molekylära strukturer av föreningar som inte kan kristalliseras och avbildas med röntgenstrålar, och dess utvecklare vann Nobelpriset i kemi 2017.
När UC Berkeley-teamet hade strukturen, Nguyen sa, det blev tydligt varför genetiska mutationer i vissa av proteinerna i telomeras interfererar med enzymet och orsakar sjukdom. 1999, Collins upptäckte den första kända mänskliga sjukdomen orsakad av en telomerasmutation:en mutation i ett telomerasprotein som kallas dyskerin som är ansvarigt för en sällsynt sjukdom som kallas dyskeratosis congenita. Patienter utvecklar anemi såväl som hud- och tarmproblem, och dör oftast av benmärgssvikt.
Anledningen, Collins säger, är att det finns två dyskerinmolekyler bundna till RNA-ryggraden som inte bara måste nå ut till nätverket av andra proteiner utan också vidröra varandra, och sjukdomsalstrande mutationer förhindrar dessa kopplingar, förlamar RNA-ryggradens förmåga att överleva i celler. Vissa barn med dyseratosis congenita har telomerasnivåer på cirka 25 procent av det normala och en livslängd på mindre än två decennier. De med hälften av den normala nivån av telomeras når vanligtvis en hälsokris i mitten av livet.
Collins är extatisk över att äntligen ha en definitiv struktur för telomeras och ser fram emot att lära sig mer om den invecklade sammansättningsprocessen av ett av de mest komplexa enzymerna i kroppen:ett polymeras lika komplicerat som ribosomen, som läser RNA för att producera proteiner.
"Jag trodde inte att det skulle vara så komplicerat när jag bestämde mig för att studera den här molekylen, " sa hon. "Jag blev nyfiken på hur telomeras fungerar 1991, när jag precis avslutade som student, och jag letade efter ett riktigt enkelt polymerassystem för att förstå nukleinsyrainteraktioner. Och jag trodde, herregud du kan inte vara enklare än så här. Det var supernaivt."