Kredit:Wiley
Hur kan eliminering av läkemedel från blodomloppet eller deras tidiga enzymatiska nedbrytning undvikas vid systemisk leverans? Kinesiska forskare har nyutvecklat en metod för att binda ett etablerat cancerläkemedel, floxuridin, med naturligt serumalbumin för dess transport och leverans till målcancerceller. I journalen Angewandte Chemie , författarna visar den automatiserade syntesen av en konjugerad floxuridinpolymer, dess framgångsrika transport och leverans, och dess effektivitet när det gäller att stoppa tumörtillväxt.
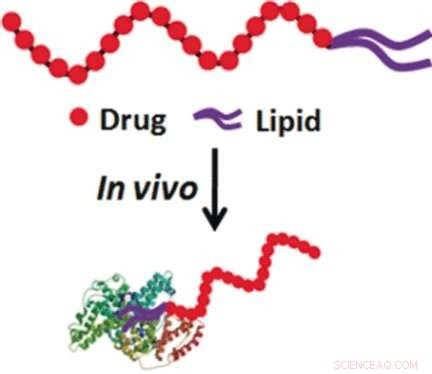
Hur kan vi få en drog till sitt mål? Trots stora framsteg inom nanobärarforskning, problemet är fortfarande ihållande, speciellt inom cancerterapi. Under transport i blodomloppet, läkemedel mot cancer kan störa friska celler, eller så kan de brytas ned av enzymer eller elimineras från kroppen innan de kommer in i tumörvävnaden. Föreställer sig ett naturligt och säkert bärsystem, Weihong Tan och kollegor vid Hunan University, Kina, och University of Florida, USA, valde endogent serumalbumin som en möjlig nanotransportör. För att säkerställa bindning av antimetaboliten floxuridin till albumin, de var tvungna att ändra den.
Floxuridin är en fluorerad pyrimidinnukleosid och antimetabolit, som hämmar enzymerna i DNA-syntesen. Dess oligomer, en oligonukleotid på 10 enheter, är ännu effektivare och internaliseras aktivt i cellen. För att göra det transporterbart med serumalbumin, Prof. Tan och hans grupp bestämde sig för att förse oligonukleotiden med hydrofoba alkylkedjor som länk. Detta var nödvändigt eftersom albumin naturligt transporterar lipofila molekyler som lipider och kolesterol, men inte negativt laddade oligonukleotider.
Syntesen av den alkylkedjekonjugerade floxuridinoligonukleotiden innehållande 20 enheter (LFU20) fortsatte på en DNA-syntes. Författarna testade föreningen för dess interaktion med serumalbumin, cell internalisering, transport genom blodomloppet i tumörimplanterade möss, och tumörproliferation. De observerade att även om en stor del av drogen fortfarande lämnade kroppen, en mycket högre andel än i kontrollgruppen ackumulerad i tumören. Där, läkemedlet internaliserades i cellerna. Den "förbättrade permeabilitets- och retentionseffekten" styrde ackumuleringen, en effekt väl etablerad inom tumörforskning. I cellerna, lysosomerna tar upp läkemedlet, och enzymer frisätter den antimetaboliska floxuridinstrukturen, noterar författarna.
Forskarna rapporterade att tumörproliferation stoppades av den lipidkonjugerade föreningen, medan det fria FU20-läkemedlet utan lipidankare inte kunde stoppa tumörtillväxt. Detta betyder att LFU20 verkar "lifta" med albumin för att hitta målcellerna och ackumuleras däri. Författarna påpekade också att läkemedlet lätt framställs genom automatiserad syntes, och den hydrofoba lipidsvansen, som säkerställer albuminaffiniteten, kan lätt inkorporeras vid 5'-terminalen av oligonukleotiden. Lifta med dödande potential lönar sig i drogtillförseln.