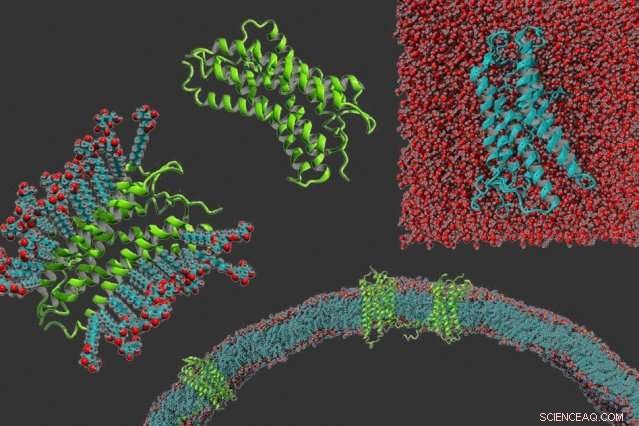
Medurs från vänster:en g-proteinkopplad receptor i tvättmedel, proteinet i sig, en g-proteinkopplad receptor som har gjorts vattenlöslig, och g-proteinkopplade receptorer inbäddade i ett membran. Kredit:Michael Skuhersky
Cirka 30 procent av proteinerna som kodas av det mänskliga genomet är membranproteiner – proteiner som spänner över cellmembranet så att de kan underlätta kommunikationen mellan celler och deras miljö. Dessa molekyler är avgörande för inlärning, seende, och känner av lukter, bland många andra funktioner.
Trots förekomsten av dessa proteiner, forskare har haft svårt att studera deras strukturer och funktioner eftersom de membranbundna delarna är mycket hydrofoba, så de kan inte lösas i vatten. Detta gör det mycket svårare att göra strukturella analyser, såsom röntgenkristallografi.
I ett förskott som skulle kunna göra det lättare att utföra denna typ av strukturstudier, MIT-forskare har utvecklat ett sätt att göra dessa proteiner vattenlösliga genom att byta ut några av deras hydrofoba aminosyror mot hydrofila. Tekniken bygger på en kod som är mycket enklare än tidigare utvecklade metoder för att göra dessa proteiner lösliga, som förlitar sig på datoralgoritmer som måste anpassas till varje protein från fall till fall.
"Om det inte finns någon regel att följa, det är svårt för folk att förstå hur man gör, " säger Shuguang Zhang, en huvudforskare vid MIT Media Labs Center for Bits and Atoms. "Verktyget måste vara enkelt, något som alla kan använda, inte en sofistikerad datorsimulering som bara ett fåtal människor vet hur man använder."
Zhang är seniorförfattaren till studien, som visas i Proceedings of the National Academy of Sciences veckan den 27 augusti. Andra MIT-författare är tidigare gästprofessor Fei Tao, postdoc Rui Qing, tidigare gästprofessor Hongzhi Tang, doktorand Michael Skuhersky, före detta grundexamen Karolina Corin '03, SM '05, Ph.D. '11, tidigare postdoktor Lotta Tegler, doktorand Asmamaw Wassie, och före detta undergraduate Brook Wassie '14.
En enkel kod
Av de cirka 8, 000 kända membranproteiner som finns i mänskliga celler, forskare har upptäckt strukturer i cirka 50. De anses allmänt vara mycket svåra att arbeta med, eftersom när de väl har extraherats från cellmembranet, de bibehåller bara sin struktur om de är suspenderade i ett rengöringsmedel, som efterliknar den hydrofoba miljön i cellmembranet. Dessa tvättmedel är dyra, och det finns inget universellt tvättmedel som fungerar för alla membranproteiner.
Zhang började arbeta på ett nytt sätt att ta itu med detta problem 2010, inspirerad av den sene Alexander Rich, en MIT-professor i biologi. Rich ställde frågan om proteinstrukturer som kallas alfaspiraler, som utgör huvuddelen av den membraninbäddade delen av proteiner, kan bytas från hydrofob till hydrofil. Zhang började genast utarbeta möjliga lösningar, men problemet visade sig vara svårt. Under de senaste åtta åren, han har haft flera studenter och gästforskare som hjälpt till med hans idé, senast Qing, som nådde framgång.
Nyckelidén som gjorde det möjligt för Zhang att utveckla koden är det faktum att en handfull hydrofoba aminosyror har mycket liknande strukturer som vissa hydrofila aminosyror. Dessa likheter gjorde det möjligt för Zhang att komma med en kod där leucin omvandlas till glutamin, isoleucin och valin omvandlas till treonin, och fenylalanin omvandlas till tyrosin.
En annan viktig faktor är att ingen av dessa aminosyror är laddade, så att byta ut dem verkar ha en minimal effekt på den övergripande proteinstrukturen. Faktiskt, isoleucin och treonin är så lika att ribosomer, cellstrukturerna som sätter ihop proteiner, infoga fel ibland - ungefär en gång på 200 till 400 förekomster.

Postdoc Rui Qing och huvudforskaren Shuguang Zhang ledde arbetet med att hitta ett enkelt sätt att göra membranbundna proteiner vattenlösliga. Kredit:Jun Ni
Forskarna kallar sin kod för QTY-koden, efter de tre bokstäverna som representerar glutamin, treonin, och tyrosin, respektive.
I sina tidigaste ansträngningar att implementera denna kod, forskarna ersatte bara en liten del av de hydrofoba aminosyrorna som var inbäddade i membranet, men de resulterande proteinerna behövde fortfarande lite rengöringsmedel för att lösas upp. De ökade ersättningsgraden till cirka 50 procent, men proteinerna var fortfarande inte helt vattenlösliga, så de ersatte alla förekomster av glutamin, isoleucin, valin, och fenylalanin inbäddat i membranen. Den här gången, de nådde framgång.
"Det är först när vi ersätter alla hydrofoba rester i de transmembrana regionerna som vi kan få proteiner som är stabila och helt fria från tvättmedel i ett vattensystem, " säger Qing.
Strukturella likheter
I den här studien, forskarna visade sin teknik på fyra proteiner som tillhör en klass av proteiner som kallas G-proteinkopplade receptorer. Dessa proteiner hjälper celler att känna igen molekyler, såsom hormoner, eller immunmolekyler, kallas kemokiner, och utlösa ett lämpligt svar inom cellen.
Joel Sussman, en professor i strukturbiologi vid Weizmann Institute of Science, beskrev den nya metoden som "otroligt enkel och elegant."
"Även om ett antal forskare har försökt hitta ett sätt att 'solubilisera' G-proteinkopplade receptorer och andra integrerade membranproteiner, hittills har deras metoder inte varit till allmän användning och ofta involverat mycket komplexa beräkningsmetoder som inte skulle vara allmänt tillämpliga, säger Sussman, som inte var involverad i forskningen.
Forskarna arbetar fortfarande med att få fram de exakta strukturerna för dessa proteiner med hjälp av röntgenkristallografi eller kärnmagnetisk resonans (NMR), men de utförde några experiment som tyder på att strukturerna liknar varandra. I ett, de visade att de vattenlösliga proteinerna denaturerar vid nästan samma temperatur som de ursprungliga versionerna av proteinerna. De visade också att de modifierade proteinerna binder till samma målmolekyler som de ursprungliga proteinerna binder till, fast inte lika starkt.
Att kunna syntetisera vattenlösliga versioner av dessa proteiner skulle kunna möjliggöra nya tillämpningar, såsom sensorer som kan upptäcka miljöföroreningar, säger forskarna.
En annan möjlighet är att designa vattenlösliga versioner av de proteiner som binder till molekyler som normalt uttrycks av cancerceller, som kan användas för att diagnostisera tumörer eller identifiera metastaserande cancerceller i blodprover, säger Zhang. Forskare kan också skapa vattenlösliga molekyler där en membranbunden receptor som virus normalt binder till är fäst vid en del av en antikropp. Om dessa "locketerapier" injicerades i kroppen, virus skulle binda till receptorerna och sedan rensas bort av immunsystemet, som skulle aktiveras av antikroppsdelen.