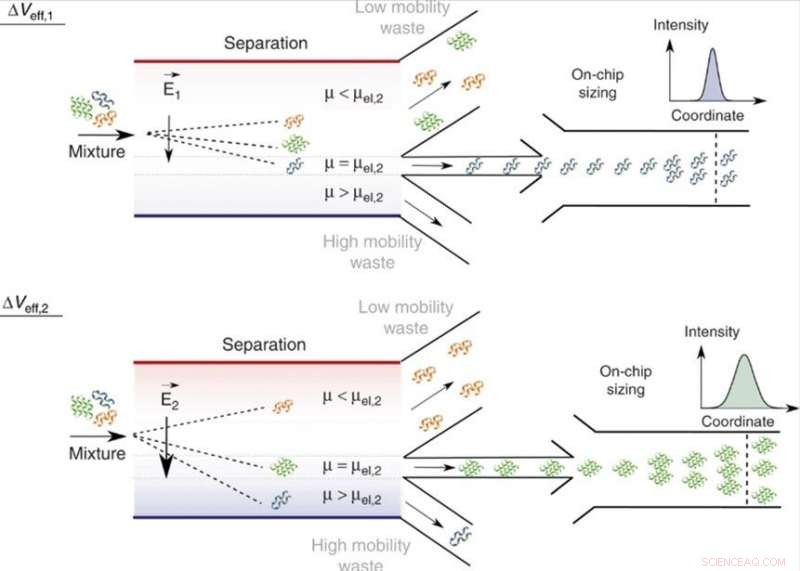
On-chip separation och analys av blandningar i flytande fas. Genom att justera den effektiva spänningen, Δveff, molekyler med en specifik elektroforetisk rörlighet, μ = μel, och därmed ett specifikt förhållande mellan laddning och hydrodynamisk radie, qRh, kan riktas till analysområdet med de för mindre (μ < μel) och större (μ > μel) mobilitetsvärden riktade till avfallsinsamlingskanalerna. Eftersom den pålagda spänningen kan varieras, endast en enda analysenhet krävs och separeringskammarens bredd kan hållas begränsad, vilket gör att enheten bibehåller en hög spänningseffektivitet och en snabb bearbetningshastighet. Inom analysområdet, fraktionerna dimensioneras genom mikrofluidisk diffusionsdimensionering (MDS) genom att övervaka deras spatiotemporala rörelse under laminära flödesförhållanden. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3
Mikrofluidiska system används inom molekylärbiologi, biokemi och bioteknik för att snabbt analysera heterogena biomolekylära blandningar med höga återvinningshastigheter och små provvolymer. Dock, det är utmanande att kombinera förberedande och analytiska processer i en enda enhet för snabb integrerad analys. I en nyligen publicerad studie nu publicerad på Mikrosystem och nanoteknik , Kadi L. Saar och medarbetare vid de tvärvetenskapliga avdelningarna för kemi, fysik, och Fluidic Analytics Limited i Cambridge, STORBRITANNIEN., har utvecklat ett chip som kombinerar de två stegen förberedelse och analys.
Initialt, de använde spänning för att separera proteinmolekyler i en binär blandning av lika stora biomolekyler som inte kunde urskiljas via konventionella dimensionerings- eller upplösningstekniker. Därefter, forskargruppen använde den nya enheten för att få ett 2D-fingeravtryck av en heterogen proteinblandning. Resultaten kommer att öppna nya möjligheter att få snabb multiparameterdata om biomolekylära system på kort tidsskala.
Mikrofluidiktekniker är attraktiva att analysera biologiska prover på grund av mycket låga provbehov och en hög återvinningsgrad. Plattformarna kan ge oöverträffad analyshastighet på nivån för enskilda driftenheter eller förse flera enheter med direkt kombinerat arbetsflöde, utan provöverföring mellan enheterna. Sådana överföringar sker genom kopplingar eller rör och inför dispersion till provet, påverkar systemets prestanda. Arbetsflödet som föreslås häri kan separera heterogena blandningar för att bestämma komponenterna av intresse och minska komplexiteten för vidare bearbetning av blandningen för dess rening.
Forskare hade tidigare introducerat en mängd kontinuerliga flödesbaserade molekylära separationsstrategier i mikronskala, inklusive friflödeselektrofores, dielektrofores, magnetofores och akustoforetisk separation. Detektionsstrategier som laser- eller LED-inducerad fluorescens (LIF), kemiluminescens eller elektrokemiska tillvägagångssätt kan vara ingrodda parallellt inom sådana mikrofluidiska separationsplattformar. Analytisk information om de separerade föreningarna kan uppnås med offlinestrategier som masspektroskopi eller SDS-PAGE, men teknikerna kan begränsa bearbetningshastigheten i en enda enhet, orsakar provförlust eller kontaminering.
Saar et al. utvecklade därför helt integrerad separation och kvantitativ karakterisering av heterogena biomolekylära prover i en enda mikrofluidisk enhet för att övervinna de befintliga gränserna genom att direkt koppla on-chip-separation till on-chip-analys och molekylstorlek. Designfunktionen möjliggjorde analys av en specifik fraktion genom att justera den applicerade fältstyrkan. De designade enheten för att identifiera separerade fraktioner som liknar SEC-MALS (storleksuteslutningskromatografi med flervinkelljusspridning) eller LC (chip)-MS ((på-chip)-vätskekromatografi-masspektrometri) metoder.
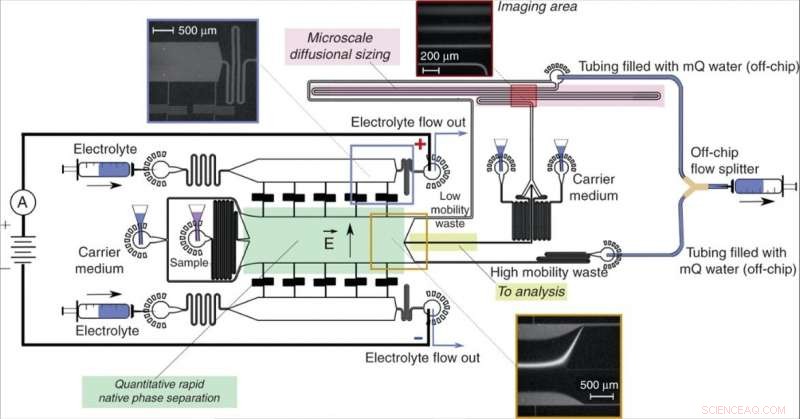
Enhetsdesign och drift. En friflödeselektroforesenhet (grön), möjliggör snabb separation av analytmolekyler i deras naturliga fas och ger kvantitativ information om separationsprocessen, riktade fraktioner av provet (gult) till en nedströms analysprocess som involverar mikrofluidisk diffusionsdimensionering (MDS; rosa). Provet karakteriserades genom att övervaka en enda bildram (infälld upp till höger) för att samtidigt extrahera storlekarna och laddningarna för de separerade fraktionerna. Enheten manövrerades genom att applicera ett undertryck vid dess utlopp med en Y-formad off-chip flödesdelare som höll lösningarna från kanalerna för "avfall med låg mobilitet" och "avfall med hög mobilitet" åtskilda för att undvika partiell kortslutning av enheten. Den elektriska potentialen applicerades från elektrolytlösningens utlopp med användning av en strömmande elektrolytlösning såsom beskrivits tidigare13. Elektrolytlösningens flöde, som inkluderade ett fluorescerande spårämne för dess visualisering, valdes så att elektrolyten skulle nå sitt utlopp snarare än att dras in i separationskammaren utan att nå den (infälld upptill till vänster), ändå skulle det läcka in i kammaren på ett kontrollerat avstånd, lämnar tillräckligt med utrymme för att avleda provstrålen (botteninsats). Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3
Enheten hade den ytterligare fördelen att utföra hela processen helt invandad för elektroforetisk separation i fri lösning, gör det möjligt för forskare att få fram en kvantitativ karta på några minuter – mycket snabbare än konventionella tekniker. Blandningen var opåverkad av det bärande mediet, och forskarna kunde studera både svaga och icke-kovalenta molekylära interaktioner.
Saar et al. konstruerade enheten med användning av en kvantitativ elektroforesenhet med naturlig fas kopplad till en MDS-enhet (microfluidic diffusional device sizing). Den kombinerade plattformen tillät komponenter med specifik elektroforetisk rörlighet (µ e1 ) för on-chip nedströmsanalys, som en funktion av den applicerade elektriska fältstyrkan. De designade tre kanaler nedströms elektroforesenheten för att hålla elektrolysprodukter borta från chipet utan att komma in i enheten. De minimerade antalet individuella enheter som drev flödet i enheten, kopplad till stabil enhetsdrift för kvantitativ provkarakterisering. Forskarna höll elektrolytens utlopp åtskilda från den kombinerade enheten för att applicera elektrisk potential över enheten utan att generera en elektrisk kortslutning, och att möjliggöra ett effektivt avlägsnande av alla elektrolysprodukter utan ackumulering för att förhindra tryckfluktuationer.
Forskargruppen tillämpade den elektriska potentialen på metalliska kontakter för att generera ett metall- och vätskegränssnitt utanför chipet i enlighet med enhetsprototypen designad av samma team. I det här arbetet, Saar et al. designade en Y-formad flödesdelare och höll isär strömmarna tills de nådde splittern för att förhindra partiell kortslutning. De beräknade flödet av elektrolyten in i enheten för att ha en effekt på enhetens prestanda.
(a) Spänningen som applicerades över elektroforeskammaren justerades i linjära steg för att rikta specifika fraktioner till analys. (b) Fraktionerna dimensionerades sedan genom att avbilda diffusionsdimensioneringsenheten bestående av fyra kanaler i vilka graden av diffusion av analytmolekylerna in i deras omgivande bärarbuffert övervakades. (c) Den genomsnittliga storleken av analytmolekylerna i var och en av fraktionerna hittades genom att anpassa de observerade fluorescerande profilerna för olika hydrodynamiska radier (Rh) och minimera det minsta medelkvadratfelet mellan passningen (röd streckad linje) och data (blått) kontinuerlig linje). (d) Fluorescensintensiteten i analysområdet varierade beroende på koncentrationen av analyterna i var och en av fraktionerna (överst) och storleken på komponenterna i en binär blandning av lysozym och bovint serumalbumin visade sig vara Rh = 1,9 nm och Rh = 3,6 nm (botten). (e) Denna binära blandning kunde inte karakteriseras med hjälp av limningstekniker som inte involverar förfraktioneringssteg, såsom dynamisk ljusspridning (DLS; ljusblå prickad linje). Dess dimensionering var möjlig med den enhet som beskrivs i detta arbete (mörkblå kontinuerlig linje). Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3 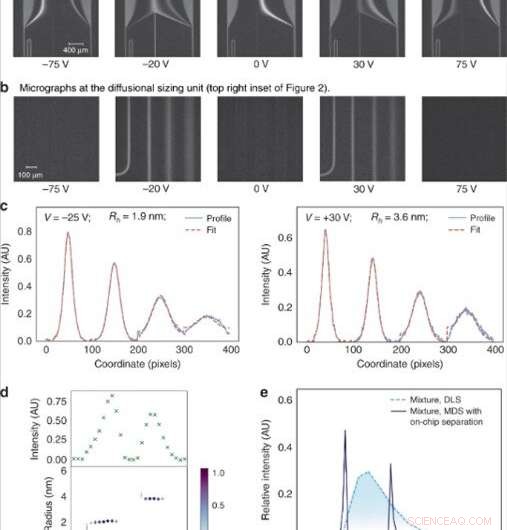
De avbildade munstycket där provet mötte bärarmediet som en referenspunkt för partikelrörelse. Forskarna justerade diffusionsdimensioneringskanalen eller flödeshastigheten för att exakt dimensionera analytmolekylerna, storleksordningar större eller mindre i storlek. Eftersom de konstruerade mikrofluidikplattformen med poly(dimetylsiloxan) (PDMS), forskarna eliminerade all autofluorescens i installationen innan de analyserade bilddata.
De använde sedan enheten för att analysera en binär blandning av provproteiner; bovint serumalbumin och humant lysozym. För att bevara de naturliga tillstånden hos proteinmolekylerna avbildade de de etikettfria proverna med ett hemmabyggt UV-våglängdsbaserat mikroskop och kvantifierade provets inneboende fluorescens. Saar et al. bekräftade förmågan att separera blandningen i dess komponenter genom att först applicera en uppsättning spänningar för att registrera de fluorescerande profilerna. De registrerade sedan proteinernas elektroforetiska rörlighet (µ e1 ) kombinerat med flödeshastigheten i enheten för att karakterisera de flesta proteiner och deras komplex. Forskarna ändrade flödeshastigheten eller den applicerade spänningen för att analysera biomolekyler med olika biofysiska parametrar.
Med hjälp av plattformen, de karakteriserade snabbt blandningar av molekyler i nanoskala, där individuella analyter visade liknande storlekar men olika elektroforetiska egenskaper. Baserat på det resulterande histogrammet, forskargruppen bekräftade närvaron av två distinkta prover. Jämförelsevis, i en off-chip konventionell separationsmetod, det senare steget krävde fraktionering genom provöverföring från ett analysverktyg till ett annat via sammankopplade rör, begränsa enhetens prestanda. Den totala proteinkoncentrationen i studien var ungefär 100 µM och forskarna upptäckte exakt känslighetsgränsen till ungefär 100 nM, i förhållande till den inneboende fluorescensen av proteinfraktioner. För optiskt icke-aktiva föreningar, Saar et al. föreslå en alternativ detektions- och karakteriseringsstrategi, såsom torrmassaavkänning.
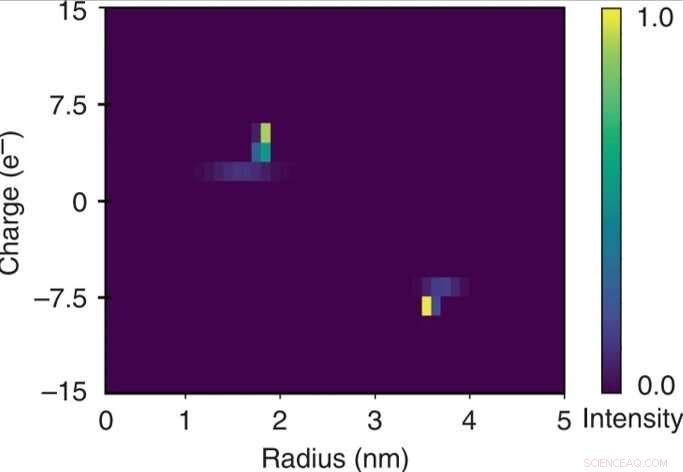
Snabb tvådimensionell karakterisering av en blandning av bovint serumalbumin och humant lysozym. Den kvantitativa karaktären hos den elektroforetiska separationsenheten gjorde att den applicerade potentialen kunde relateras till den elektroforetiska rörligheten μel för var och en av fraktionerna. Dessa data användes i kombination med de extraherade hydrodynamiska radierna (Rh) för att uppskatta de effektiva laddningarna (q) för molekylerna i var och en av fraktionerna och för att konstruera en tvådimensionell q vs Rh-karta av blandningen över några minuters tidsskala genom att övervakning av enheten endast vid en enda bildram. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3
Saar et al. använde strategin för att erhålla tvådimensionella (2-D) karakteristiska kartor över proteinblandningen som ett proof-of-concept. De extraherade kvantitativ information från separationssteget och relaterade de applicerade potentialerna till artens elektroforetiska rörlighet för att uppskatta enhetens effektivitet. De registrerade strömmen som flyter i systemet under normal drift och när separationskammaren kortslutits för att uppskatta enhetens och elektrodernas totala elektriska resistans.
Forskarna beräknade den elektroforetiska rörligheten som rörelsen av en partikel i ett elektriskt fält för var och en av fraktionerna. Baserat på experimentella data, den konstruerade 2-D karakteristiska kartan inkluderade den effektiva laddningen (q) och den hydrodynamiska radien (Rh) för blandningen. De resulterande elementära laddningsenheterna för de specifika proteinerna överensstämde med uppskattade värden någon annanstans. De erhöll den fullständiga tvådimensionella kartan genom att endast övervaka en enda bildram för snabb lösningsanalys.
Den analytiska tiden för mikrofluidikanordningen från separation till diffusionsdimensionering och avbildning var ungefär 14 sekunder. Forskarna konstruerade den experimentella 2D-kartan med endast 3 µL prov under sju minuter totalt, storleksordningar snabbare än tidsskalan för att utföra konventionella 2D-proteingeler. Forskargruppen genomförde ett brett utbud av biomolekylära interaktioner, i lösning, direkt under inhemska förhållanden som tidigare var utmanande att utföra i labbet.
På det här sättet, Kadi L. Saar och hans medarbetare utvecklade en mikrofluidisk enhet som kombinerar separation på chip med direkt analys på chip för att ersätta de befintliga konventionella metoderna i mikroskala. Använda enheten, de analyserade snabbt en binär blandning av proteiner som inte kunde identifieras som individuella komponenter via befintliga lösningsdimensioneringsmetoder. De konstruerade en 2-D karakteristisk karta över den heterogena blandningen på en snabb tidsskala för att öppna möjligheten för proteinkarakterisering i lösning med en aldrig tidigare skådad tidsupplösning jämfört med befintliga biofysiska tekniker.
© 2019 Science X Network