Kredit:RUDN University
RUDN University bioingenjörer har skapat magnetiska nanobehållare för smart leverans av läkemedel till önskade organ eller vävnader, vilket minskar risken för biverkningar. Ett experiment på möss visade att nanobehållarna är giftfria. Resultaten av studien publiceras i tidskriften Polymerer .
Farmaceutiska biverkningar uppstår ofta eftersom den aktiva substansen i läkemedlet kommer in i friska organ. Det är därför, till exempel, kemoterapi är så svårt för patienter vid behandling av cancer:Giftiga läkemedel påverkar inte bara tumörceller, men hela kroppen. Riktade läkemedelsleveranssystem löser detta problem. Många potentiella bärare har föreslagits under de senaste åren:mikrokapslar med ett skal av polyelektrolyter, konstgjorda liposomer i mikro- och nanoskala, och protein -nanopartiklar, till exempel. Flera dussin läkemedel förpackade i sådana behållare används redan i praktiken eller genomgår kliniska prövningar.
Dock, det finns fortfarande många problem som förhindrar en utbredd användning av smarta bärare. En är att beroendet av biodistributionsprocessen för läkemedel i vävnader dikterar storleken på behållarna. Ju mindre storlek, ju större sannolikhet är att läkemedlet når rätt organ, och ju lägre dosen av läkemedlet krävs, minska toxiska effekter. Ett annat problem är bristen på information om toxicitet, effekter på kroppen och distribution i levande vävnader. Båda dessa problem har framgångsrikt lösts av RUDN-universitetets biokemister i samarbete med kollegor från Ryssland och Storbritannien.
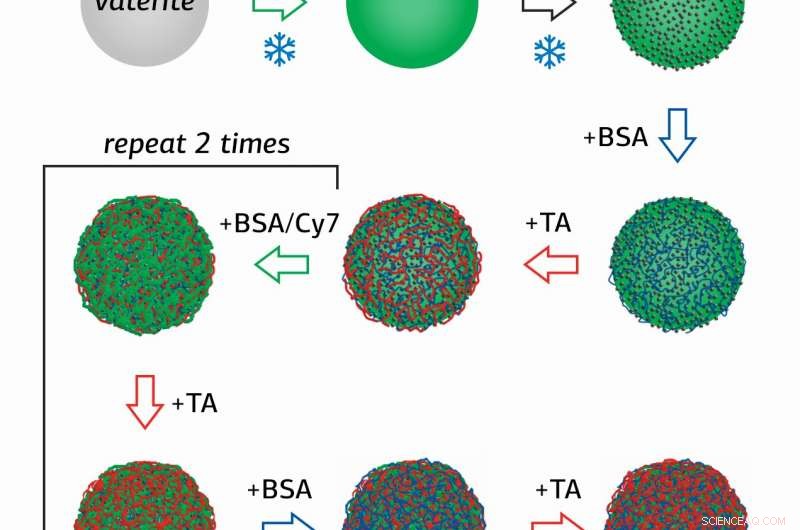
Forskare vid Surface Engineering Laboratory vid RUDN University Olga Sindeeva och hennes medförfattare skapade magnetiskt känsliga behållare i submikronskala – partiklar på 400-600 nanometer, med ett skal av flera lager av bovint serumalbumin (BSA) med en fluorescerande tagg Cy7, och garvsyra (TA).
Nyheten i studien är metoden för att erhålla behållare, i vilka nanopartiklar av magnetit (MNP), blandad järnoxid (II, III) adsorberades först på ytan av porösa granuler av kalciumkarbonat, som sedan belades sekventiellt med flera lager av BSA-Cy7 och TA. Sedan, Kalciumkarbonat tvättades ut ur behållarna med användning av en vattenlösning med ett kelatbildande medel.
"Med denna metod, det var möjligt att fördubbla mängden magnetit i behållare jämfört med vad som erhålls genom adsorptions- och samavsättningsmetoder. Således, det är möjligt att öka det magnetiska momentet hos nanobehållare och öka hastigheten på deras rörelse i kärlsystemet, " förklarade Olga Sindeeva.
RUDN University bioingenjörer förväntar sig att submikronstorleken på behållarna ökar biotillgängligheten för läkemedlet som laddas i MNP:erna (BSA-Cy7-TA).
Preliminära experiment på två cellinjer, HeLa och fibroblaster, har visat att behållarna inte påverkar cellviabiliteten och kan användas in vivo.
De läkemedelsfria behållarna testades sedan på levande BALB/c-möss av båda könen som väger cirka 20 gram, 10 personer per grupp. Behållare i form av en suspension i saltlösning injicerades i svansvenen på sövda möss. En suspension av magnetitfria behållare (BSA-Cy7-TA) användes som kontroll. Sedan, ett av bakbenen på mössen exponerades för ett magnetfält under en timme medan det andra lämnades fritt för jämförelse. Fördelningen av nanokontainers i vävnaderna hos levande möss observerades med hjälp av magnetisk resonanstomografi (MRI) och fluorescerande tomografi. Magnetometrisk analys och histologisk undersökning av postmortem möss vävnader utfördes också en timme efter avlägsnande av magneten.
Biologer vid RUDN University har visat att i de perifera kärlen i bakbenen i vila vid en låg blodflödeshastighet, MNPs(BSA-Cy7-TA)-partiklar rör sig under den första timmen efter intravenös injektion i riktning mot den lem som magneten är fäst vid.
MR visade att koncentrationen av magnetit i muskeln nära magneten passerar maximalt. Magnetitmängden visade sig vara 70 procent högre än i den fria extremiteten. Sedan, magnetitsignalen sjönk till bakgrundsvärden.
Enligt resultaten av histologiska studier och magnetometri, forskarna fann att MNP (BSA-Cy7-TA) koncentrerades huvudsakligen i lungorna, och, i mindre grad, i levern och mjälten. Dessutom, deras koncentration i lungorna var fyra till fem gånger högre. En liten mängd av bäraren hittades också i andra inre organ och muskler, men koncentrationen var betydligt lägre än i lungorna. Således, biokemister drog slutsatsen att fördelningen av intravenösa behållare beror på blodtillförseln till organen, det är, på blodflödets hastighet, men är känslig för lokaliseringen av magnetfältet.
Särskild uppmärksamhet ägnades åt toxiciteten hos intravenösa behållare och deras effekter på kroppen. Preliminära tester har visat att in vitro i plasma eller blod, en betydande andel av behållarna förstörs under en dag. Resultaten av studierna tyder på att behållarna hinner nå målet med intravenös injektion. Sedan, genom att ändra fluorescenssignalen, bärarpartiklarna bryts gradvis ned och utsöndras från kroppen.
Partiklarna är giftfria och hemokompatibla, och deras storlek gör att de kan tränga in i kroppens vävnader, men i arbetsdoser, de skadar inte andnings- eller cirkulationssystemet, och påverkar inte njur- eller leverfunktioner. Aktiveringen av komplementsystemet som är nödvändigt för biologisk nedbrytning av proteinmembranet i behållarna påverkar inte nivån av leukocyter, och leder därför inte till någon märkbar systematisk inflammation.
Således, RUDN -universitetets forskare kunde konstruera och distribuera behållare med en stor mängd magnetit i kroppen, och effektivt hantera deras utbyggnad med hjälp av ett magnetfält.
I framtiden, Projektdeltagarna har för avsikt att skapa smarta nanokapslar som kan leverera läkemedlet till rätt organ och öppna för att frigöra den aktiva substansen. Denna metod för läkemedelstillförsel skulle undvika biverkningar av behandlingen. Patienter med en rad sjukdomar, inklusive barn eller äldre med dålig hälsa, skulle kunna behandlas med läkemedel som annars skulle kunna undvikas på grund av biverkningar som förvärrar patientens tillstånd.