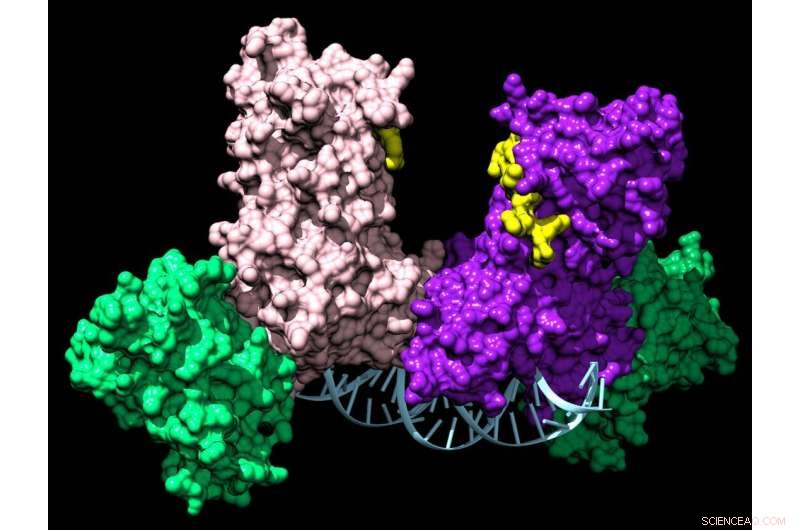
Ett par DNMT3A-enzymer förenar två hjälpproteiner (gröna) för att bilda ett fyrdelat komplex som färdas längs DNA och lägger till kemiska taggar som talar om för en cell vilka gener som ska uttryckas. Kredit:Jonathan Sandoval et al.
Kemoterapi suger. Behandlingarna har i allmänhet fruktansvärda biverkningar, och det är ingen hemlighet att de inblandade läkemedlen ofta är giftiga för patienten såväl som deras cancer. Tanken är att eftersom cancer växer så snabbt kommer kemoterapi att döda sjukdomen innan dess biverkningar dödar patienten. Det är därför forskare och läkare ständigt söker efter effektivare terapier.
Ett team ledd av forskare vid UC Santa Barbara, och inklusive medarbetare från UC San Francisco och Baylor College of Medicine, har identifierat två föreningar som är mer potenta och mindre toxiska än nuvarande leukemiterapier. Molekylerna fungerar på ett annat sätt än vanliga cancerbehandlingar och kan utgöra grunden för en helt ny klass av läkemedel. Dessutom används föreningarna redan för att behandla andra sjukdomar, vilket drastiskt minskar mängden byråkrati som är involverad i att skräddarsy dem mot leukemi eller till och med förskriva dem off-label. Resultaten visas i Journal of Medicinal Chemistry .
"Vårt arbete med ett enzym som är muterat hos leukemipatienter har lett till upptäckten av ett helt nytt sätt att reglera detta enzym, såväl som nya molekyler som är mer effektiva och mindre giftiga för mänskliga celler", säger UC Santa Barbara Distinguished Professor Norbert Reich, studiens motsvarande författare.
Epigenomet
Alla celler i din kropp innehåller samma DNA, eller genom, men var och en använder olika delar av denna ritning baserat på vilken typ av cell det är. Detta gör det möjligt för olika celler att utföra sina specialiserade funktioner samtidigt som de fortfarande använder samma bruksanvisning; i huvudsak använder de bara olika delar av manualen. Epigenomet talar om för cellerna hur de ska använda dessa instruktioner. Till exempel avgör kemiska markörer vilka delar som läses, vilket dikterar en cells faktiska öde.
En cells epigenom kopieras och bevaras av ett enzym (en typ av protein) som kallas DNMT1. Detta enzym säkerställer till exempel att en levercell som delar sig förvandlas till två leverceller och inte en hjärncell.
Men även hos vuxna behöver vissa celler differentiera sig till olika typer av celler än de var tidigare. Till exempel kan benmärgsstamceller bilda alla olika blodcellstyper, som inte reproducerar sig själva. Detta kontrolleras av ett annat enzym, DNMT3A.
Detta är väl och bra tills något går fel med DNMT3A, vilket gör att benmärgen förvandlas till onormala blodkroppar. Detta är en primär händelse som leder till olika former av leukemi, såväl som andra cancerformer.
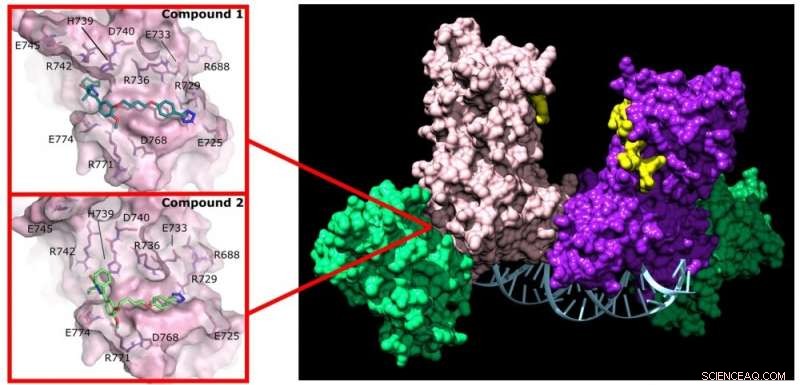
Pyrazolon (förening 1) och pyridazin (förening 2) stör aktiviteten av DNMT3A genom att binda till ett icke-aktivt ställe på enzymet. Kredit:Jonathan Sandoval et al.
Toxiska behandlingar
De flesta cancerläkemedel är utformade för att selektivt döda cancerceller samtidigt som de lämnar friska celler ifred. Men detta är extremt utmanande, vilket är anledningen till att så många av dem är extremt giftiga. Nuvarande leukemibehandlingar, som Decitabine, binder till DNMT3A på ett sätt som inaktiverar det, och bromsar därigenom utvecklingen av sjukdomen. De gör detta genom att täppa igen enzymets aktiva plats (i huvudsak dess affärsända) för att förhindra det från att utföra sin funktion.
Tyvärr är DNMT3A:s aktiva plats praktiskt taget identisk med den för DNMT1, så läkemedlet stänger av epigenetisk reglering i alla patientens 30 till 40 biljoner celler. Detta leder till en av läkemedelsindustrins största flaskhalsar:toxicitet utanför målet.
Att täppa igen ett proteins aktiva webbplats är ett enkelt sätt att ta det offline. Det är därför den aktiva webbplatsen ofta är den första plats som läkemedelsdesigners tittar på när de designar nya läkemedel, förklarade Reich. Men för ungefär åtta år sedan bestämde han sig för att undersöka föreningar som kunde binda till andra platser i ett försök att undvika effekter utanför målet.
Att arbeta tillsammans
När gruppen undersökte DNMT3A märkte de något märkligt. Medan de flesta av dessa epigenetiskt relaterade enzymer fungerar på egen hand, bildade DNMT3A alltid komplex, antingen med sig själv eller med partnerproteiner. Dessa komplex kan involvera mer än 60 olika partners, och intressant nog fungerar de som målsökande enheter för att styra DNMT3A att kontrollera särskilda gener.
Tidigt arbete i Reich-labbet, ledd av den tidigare doktoranden Celeste Holz-Schietinger, visade att att störa komplexet genom mutationer inte stör dess förmåga att lägga till kemiska markörer till DNA:t. Men DNMT3A betedde sig annorlunda när den var ensam eller i ett enkelt par; det var inte för att stanna på DNA:t och markera den ena platsen efter den andra, vilket är avgörande för dess normala cellulära funktion.
Ungefär samtidigt publicerades New England Journal of Medicine gjorde en djupdykning i de mutationer som finns hos leukemipatienter. Författarna till den studien upptäckte att de vanligaste mutationerna hos patienter med akut myeloid leukemi finns i DNMT3A-genen. Överraskande nog hade Holz-Schietinger studerat exakt samma mutationer. Teamet hade nu en direkt koppling mellan DNMT3A och de epigenetiska förändringarna som leder till akut myeloid leukemi.
Upptäcker en ny behandling
Reich och hans grupp blev intresserade av att identifiera läkemedel som kunde störa bildandet av DNMT3A-komplex som förekommer i cancerceller. De skaffade ett kemiskt bibliotek som innehöll 1 500 tidigare studerade läkemedel och identifierade två som stör DNMT3A-interaktioner med partnerproteiner (protein-protein-hämmare eller PPI).
Dessutom binder dessa två läkemedel inte till proteinets aktiva plats, så de påverkar inte DNMT1 som fungerar i alla kroppens andra celler. "Denna selektivitet är precis vad jag hoppades upptäcka med eleverna i det här projektet," sa Reich.
Dessa läkemedel är mer än bara ett potentiellt genombrott inom leukemibehandling. De är en helt ny klass av läkemedel:protein-proteinhämmare som riktar en del av enzymet bort från dess aktiva plats. "En allosterisk PPI har aldrig gjorts tidigare, åtminstone inte för ett epigenetiskt läkemedelsmål," sa Reich. "Det fick verkligen ett leende på läpparna när vi fick resultatet."
Denna prestation är ingen enkel bedrift. "Att utveckla små molekyler som stör protein-proteininteraktioner har visat sig vara utmanande", konstaterade huvudförfattaren Jonathan Sandoval från UC San Francisco, en före detta doktorand i Reichs labb. "Detta är de första rapporterade hämmarna av DNMT3A som stör protein-proteininteraktioner."
De två föreningar som teamet identifierade har redan använts kliniskt för andra sjukdomar. Detta eliminerar en hel del kostnader, tester och byråkrati som är involverade i att utveckla dem till leukemiterapier. Faktum är att onkologer skulle kunna förskriva dessa läkemedel till patienter utanför etiketten just nu.
Bygg på framgång
Det finns fortfarande mer att förstå om detta nya tillvägagångssätt. Teamet vill lära sig mer om hur protein-protein-hämmare påverkar DNMT3A-komplex i friska benmärgsceller. Reich samarbetar med kemiprofessor Tom Pettus vid UC Santa Barbara och en gemensam doktorand till deras, Ivan Hernandez. "Vi gör förändringar i läkemedlen för att se om vi kan förbättra selektiviteten och styrkan ännu mer," sa Reich.
Det finns också mer att lära sig om läkemedlens långsiktiga effekter. Eftersom föreningarna verkar direkt på enzymerna, kanske de inte ändrar de underliggande mutationerna som orsakar cancern. Denna varning påverkar hur läkare kan använda dessa läkemedel. "Ett tillvägagångssätt är att en patient skulle fortsätta att få låga doser," sa Reich. "Alternativt kan vårt tillvägagångssätt användas med andra behandlingar, kanske för att få ner tumörbördan till en punkt där det är ett alternativ att avbryta behandlingen."
Reich medger också att teamet ännu inte har lärt sig vilken effekt PPI har på benmärgsdifferentiering på lång sikt. De är nyfikna på om läkemedlen kan framkalla någon typ av cellulärt minne som kan lindra problem på epigenetisk eller genetisk nivå.
Som sagt, Reich är stark av deras upptäckt. "Genom att inte rikta in oss på DNMT3A:s aktiva sida är vi redan ligor bortom det för närvarande använda läkemedlet, Decitabine, som definitivt är cellgifter", sa han och tillade att den här typen av tillvägagångssätt kan skräddarsys för andra cancerformer också. + Utforska vidare