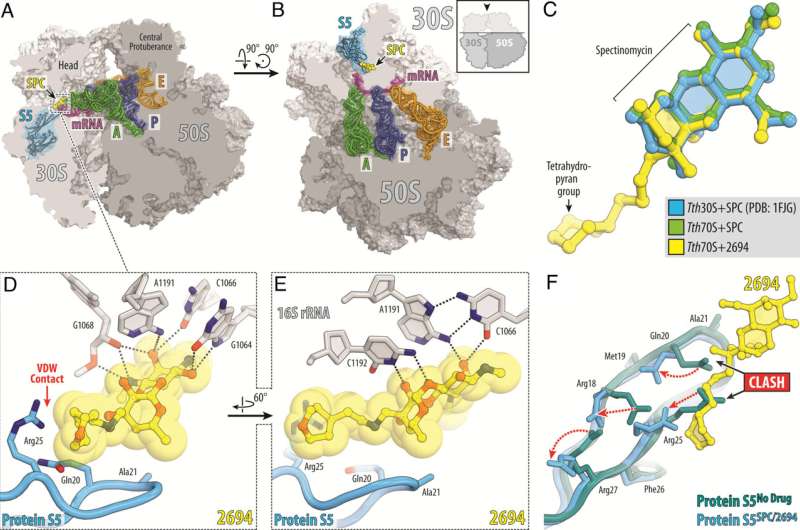
Forskare vid St. Jude Children's Research Hospital tar itu med Mycobacterium abscessus (Mab) antibiotikaresistens. Denna naturligt antibiotikaresistenta patogen blir allt vanligare, vilket understryker det akuta behovet av nya terapier. För att ta itu med detta designade forskarna nya versioner av läkemedlet spectinomycin som övervinner efflux, den huvudsakliga mekanismen som driver resistens. Verket publiceras i Proceedings of the National Academy of Science .
Mab-infektioner förekommer i allt högre grad i hälsovårdsmiljöer. Sådana infektioner kan vara farliga för patienter med nedsatt lungfunktion, såsom vid cystisk fibros, eller som är immunologiskt nedsatt, såsom barncancer. Dessa infektioner behandlas med långa antibiotikakurer och kan resultera i dåliga resultat.
Uppkomsten av Mab och andra liknande patogener utgör ett växande och djupt oroväckande hot mot folkhälsan eftersom det finns få effektiva terapeutiska alternativ och en begränsad läkemedelsutvecklingspipeline.
"Vi kemister är i en kapplöpning mot patogenerna. Vi tillverkar starkare antibiotika, och patogenerna blir mer resistenta", säger motsvarande författare Richard Lee, Ph.D., St. Jude Department of Chemical Biology and Therapeutics.
Forskare vid St. Jude modifierade det naturligt förekommande antibiotikumet spectinomycin för att skapa analoger, jämförbara men strukturellt distinkta N-etylenlänkade aminometylspektinomyciner (eAmSPCs). Dessa syntetiskt skapade eAmSPCs är upp till 64 gånger mer potenta mot Mab än standard spectinomycin.
"Genom att omarbeta molekylen genom strukturbaserad läkemedelsdesign har vi och våra samarbetspartners anpassat antibiotikan för att öka dess aktivitet," tillade Lee.
Genom sitt arbete avslöjade forskarna verkningsmekanismen genom vilken eAmSPCs är mer effektiva:de kringgår utflödet. Efflux är den process som celler använder för att bli av med ett läkemedel – föreställ dig att pumpa ut vatten ur en översvämmad källare – och är en betydande mekanism genom vilken celler blir resistenta mot terapi.
N-etenbindningsstrukturen hos eAmSPCs spelar en avgörande roll för hur föreningarna undviker utflöde, vilket tyder på att längre bindningar modifierar hur föreningen pumpas ut ur cellen. Detta förskjuter i slutändan balansen mot högre koncentrationer av eAmSPC i cellen och förbättrar därmed antimikrobiell effektivitet.
"Under de senaste två decennierna har vi sett en massiv ökning av antalet infektioner orsakade av icke-tuberkulösa mykobakterier som Mab", säger medförfattaren Gregory Phelps, PharmD, St. Jude Graduate School of Biomedical Sciences. "Vi hade en plats att börja med detta naturligt förekommande antibiotikum, som vi genom modifiering har gjort mycket mer effektivt mot denna kliniskt relevanta patogen."
Forskarna fann också att eAmSPC fungerar bra med olika klasser av antibiotika som används för att behandla Mab och behåller sin aktivitet mot andra mykobakteriella stammar. Detta arbete visar att eAmSPCs bör studeras och utvecklas ytterligare, eftersom när frågor om tolerabilitet och säkerhet väl har åtgärdats kan dessa föreningar bli nästa generations terapeutiska medel.
"Det är utmanande att locka läkemedelsföretag att utveckla nya antibiotika av flera ekonomiska skäl", säger Phelps. "Om vi kan stärka läkemedelspipelinen mot denna svårbehandlade bakterie, kan vi potentiellt göra skillnad för patienter som de vi har här på St. Jude som i allt högre grad står inför begränsade eller inga terapeutiska alternativ."
Mer information: Gregory A. Phelps et al, Development of 2nd generation aminomethyl spectinomycins that overcome native efflux in Mycobacterium abscessus, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2314101120
Journalinformation: Proceedings of the National Academy of Sciences
Tillhandahålls av St. Jude Children's Research Hospital