Kredit:Scripps Research Institute
Forskare vid The Scripps Research Institute (TSRI) har löst ett cellulärt mysterium som kan ha viktiga konsekvenser för grundläggande biologi och sjukdomar som ALS. Deras nya forskning tyder på att RNA kan vara den hemliga ingrediensen som hjälper celler att montera, organisera intern arkitektur, och slutligen lösa dynamiska droppliknande fack.
Dessa droppliknande strukturer är allmänt kända som membranlösa organeller, och de är nyckeln till hur celler uppdelar sin biokemi och reglerar processer som genuttryck och reaktion på stress.
I 200 år, forskare har känt till förekomsten av membranlösa organeller i celler och undrat hur de regleras. Nyligen genomförda studier tyder på att ökning av fraktionen av RNA kan leda till bildning av protein-RNA-droppar genom en process som kallas vätske-vätskefasseparation.
"Det är i princip samma typ av oblandbarhet som driver olja att bilda droppar i vatten, "säger TSRI -docent Ashok Deniz, som ledde studien som nyligen publicerades i tidskriften Angewandte Chemie som ett mycket viktigt papper (VIP). "Medan flera svaga biomolekylära krafter kollektivt resulterar i protein-RNA-droppbildning, vi fokuserade på en särskild typ i denna studie:elektrostatiska interaktioner som drivs av motsatt laddade biomolekyler. En stor upptäckt var att ytterligare ökning av RNA -koncentrationen kan lösa dessa droppar, återför en homogen vätskefas. "
Hastigheten med vilken dessa droppar bildas och löses upp kan vara nyckeln till cellulär överlevnad. "Droppar kan bildas och lösa sig efter behov, vilket gör att cellerna snabbt kan anpassa sig till cellulär stress, "säger forskningsassistenten Priya Banerjee, som ledde studien och fungerade som första författare med doktorander Anthony N. Milin och Mahdi Muhammad Moosa från TSRI.
Den nya studien antyder att den negativa laddningen av RNA -molekyler är en nyckel till både att skapa och lösa droppar. "RNA är som ett dubbelagent, sa Banerjee.
Hur droppar bildas och försvinner
RNA har en övergripande negativ laddning. När den initialt kommer i kontakt med positivt laddade proteiner, de motsatt laddade molekylerna lockar varandra. Tillsammans, de skapar en molekylär sammansättning och bildar flytande droppar. Dessa droppar tillåter celler att utföra viktiga funktioner.
Forskarna fann också att droppar snabbt löser sig när man ökar RNA i systemet.
"Att lägga till mer RNA i detta system stör finbalansen mellan negativa och positiva laddningar, vilket leder till bildandet av negativt laddade enheter som nu stöter bort varandra, så löser droppen, "säger studieförfattaren Paulo L. Onuchic, en doktorand i Deniz Lab.
Detta unika fynd belyser en oväntad regleringsväg. Forskningen utmanar också den tidigare uppfattningen att biomolekylära krafter som skapar droppar bör vändas för att lösa upp dem. Istället för att vända processen - genom antingen avlägsnande av RNA eller posttranslationell modifiering av proteinet för att förstöra dess positiva laddning - fann forskarna att systemet helt enkelt kan lägga till mer RNA för att lösa upp en droppe.
"Det fönsterliknande beteendet för droppbildning som en funktion av RNA-koncentration som observeras här uppvisar en enkelriktad väg som kan utnyttjas av celler med hjälp av processer som transkription, sa Banerjee.
I ytterligare experiment, teamet visade att RNA -syntes genom cellulära maskiner verkligen bildar och löser upp dessa droppar.
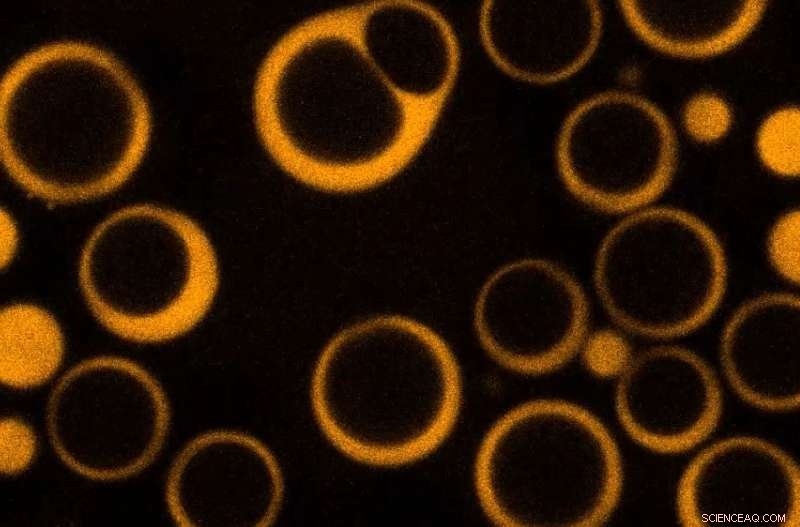
Skapa "ihåliga" droppar
Det faktum att RNA kan lösa droppar gav forskarna en unik chans att kontrollera RNA -tillägg och se upplösningsprocessen. "Till vår förvåning, istället för en enkel process för droppupplösning, vi observerade ihåliga sfärer som bildade inuti droppar. Ta ett steg tillbaka, du ser det genom att lägga till mer RNA, vi skapar droppar med låg densitet inuti droppar med hög densitet, sa Deniz.
Deniz jämförde detta fenomen med en isbit som smälter inifrån. Intressant, dessa inre droppar, kallas vakuoler, liknar de komplexa interna substrukturerna som vanligtvis observeras i ett antal cellulära droppliknande organeller.
"Nyckeln till att skapa vakuoler är denna enriktade övergång från en initial homogen vätska till två icke -blandbara vätskefaser och tillbaka till en homogen fas bara genom att öka fraktionen av RNA, "tillade Banerjee.
Teamet fortsatte med att testa om dessa fynd skulle gälla ett nyckelprotein som finns i stressgranulat, viktiga "dropp" -organeller som skyddar celler under stress. De undersökte ett RNA-bindande protein som heter FUS, som har varit inblandad i ALS.
"Med FUS, vi fann att RNA både kan bilda och lösa droppar på samma sätt som det enklare modellsystemet. Anmärkningsvärt, FUS -droppar uppvisade också komplexa interna substrukturer, som banar väg för att fastställa dessa vakuolers biologiska roll, sa Milin.
Även om denna forskning fortfarande är i ett tidigt skede, forskarna tror att mutationer i FUS kan störa den normala droppdynamiken hos vissa patienter med ALS, möjligen stoppar deras celler från att klara av cellulär stress korrekt.
Arbetet öppnar ett antal vägar för framtida forskning inom cellbiologi och sjukdom, inklusive kvantitativa studier av denna specifika typ av fasövergång i andra biologiska system, förstå de molekylära determinanterna i proteiner och RNA som styr droppdynamiken, och ytterligare studier av komplexa mönster av droppar.