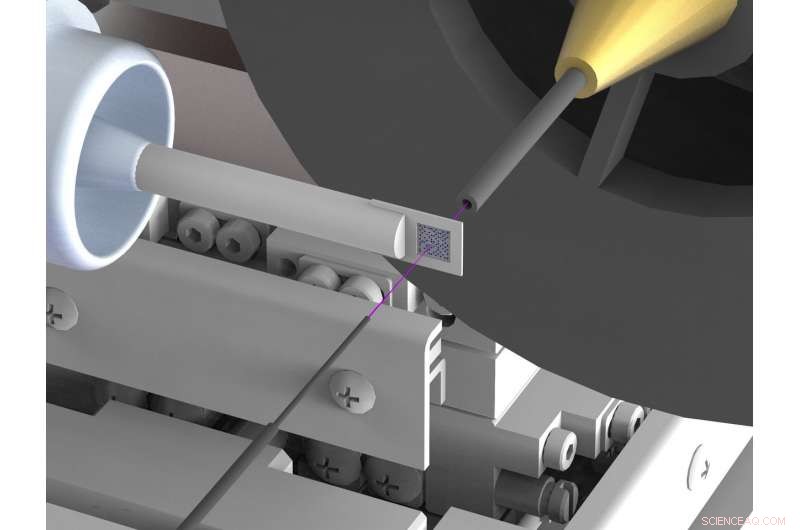
En nyutvecklad uppsättning minskar avsevärt bakgrundsspridning i röntgenstrukturanalys av biomolekyler som proteiner vid synkrotronröntgenkällor. Spridning hindrar ofta strukturbestämningar med hög upplösning. För att uppnå detta, röntgenstrålen (markerad i rosa) är innesluten i tunna metallkapillärer strax före och bakom provet och luften som omedelbart omger provet ersätts av en ström av heliumgas. Kredit:DESY, Julian Bergtholdt
En nyutvecklad experimentell uppsättning möjliggör röntgenstrukturbestämning av biomolekyler som proteiner med mycket mindre prover och kortare exponeringstider än tidigare. Vid så kallade synkrotronkällor, proteinkristall kan studeras betydligt effektivare och snabbare genom att använda bredspektrumröntgen. Dock, på grund av den stora mängden spridd strålning, detta har hittills krävt mycket stora kristaller. Den nyutvecklade experimentuppställningen tillåter nu att den oönskade spridda strålningen reduceras avsevärt, så att forskare har kunnat utföra seriell kristallografi med bredspektrum synkrotronstrålning för första gången. Det internationella teamet under ledning av DESY-forskaren Alke Meents publicerade sina resultat från experiment vid Advanced Photon Source (APS) i USA i tidskriften Naturkommunikation .
Synkrotronkällor är cirkulära partikelacceleratorer som producerar ljus röntgenstrålning. Dessa röntgenkällor är arbetshästarna för bestämning av proteinstruktur. För att klargöra den rumsliga strukturen för ett visst protein, kristaller odlas från det och undersöks med röntgenstrålar vid en synkrotron. Kristallen diffrakterar röntgenstrålarna på ett karakteristiskt sätt, och från det resulterande diffraktionsmönstret den inre strukturen av kristallen, och med den kan proteinets struktur beräknas ner till atomnivå.
I motsats till konventionell röntgenkristallografi, som vanligtvis utförs på enstaka eller ett litet antal stora proteinkristaller, seriell kristallografi tittar på hundra till hundratusentals mycket små kristaller. Den insamlade informationen slås sedan samman för att bilda en datamängd från vilken kristallstrukturen kan härledas. Denna metod har redan använts ofta med röntgenfria elektronlasrar (XFEL). Dessutom, genom att använda de mycket korta röntgenpulserna från XFEL, kemiska och enzymreaktioner kan studeras över korta tidsintervall.

Diffraktionsbild av en proteinkristall i polykromatisk, "rosa" röntgenstrålar. Jämfört med monokromatiska röntgendiffraktionsbilder, den polykromatiska bilden innehåller mycket mer information och färre kristaller krävs för att bestämma proteinets struktur. Kredit:DESY, Max Wiedorn
"Seriell kristallografi kan också enkelt utföras med synkrotronkällor. mätningarna tar längre tid med dessa källor, eftersom de använder monokromatisk röntgenstrålning av en specifik färg, vilket resulterar i ett lågt flöde av röntgenstrålar, " förklarar Henry Chapman, ledande forskare vid DESY och medförfattare till artikeln. Vid synkrotroner, vanligtvis används bara ett smalt band av röntgenvåglängder för denna typ av analys, så att bara en liten del av de tillgängliga röntgenfotonerna används för experimentet.. "Också, vi behöver många kristaller för att samla in en komplett uppsättning data - ofta flera tiotusentals. Eftersom exponeringstiderna är relativt långa med en synkrotron, det enda sättet att studera snabba reaktioner har varit med en röntgenlaser, säger Chapman.
Genom att använda den så kallade "rosa" polykromatiska strålen, Seriella kristallografiexperiment med mycket korta exponeringstider kan nu även utföras vid synkrotronstrålningskällor. Jämfört med den vanliga monokromatiska strålen, det breda spektrumet ökar antalet röntgenfotoner som är tillgängliga för att göra en mätning. Som att fotografera en mycket solig dag, bilder kan göras med kortare exponeringstider, vilket innebär att snabba reaktioner kan undersökas med hjälp av synkrotronstrålningskällor. Experimenten i sig kan också utföras med färre kristaller eftersom det breda spektrumet ger mer intrikata "färgglada" diffraktionsmönster med mer information om molekylstrukturen än att använda monokromatiska röntgenstrålar av en enda "färg".
Tills nu, dock, det har inte varit möjligt att utföra seriell kristallografi med den rosa strålen eftersom mätningarna är kraftigt försämrade av höga nivåer av bakgrund producerad med så starka strålar. "Oönskad bakgrund i de uppmätta mönstren produceras eftersom de röntgenstrålar som används för att sondera provet inte bara sprids av molekylerna i själva kristallen, men också av provhållaren och den omgivande luften, " förklarar Max Wiedorn, DESY medförfattare till tidningen. "Den faktiska signalen som mäts under experiment med den rosa strålen sprids ut över de många "färgerna", vilket innebär att den spridda bakgrundsstrålningen har en klart mer negativ inverkan på mätningarna än vad som är fallet med monokromatisk strålning."
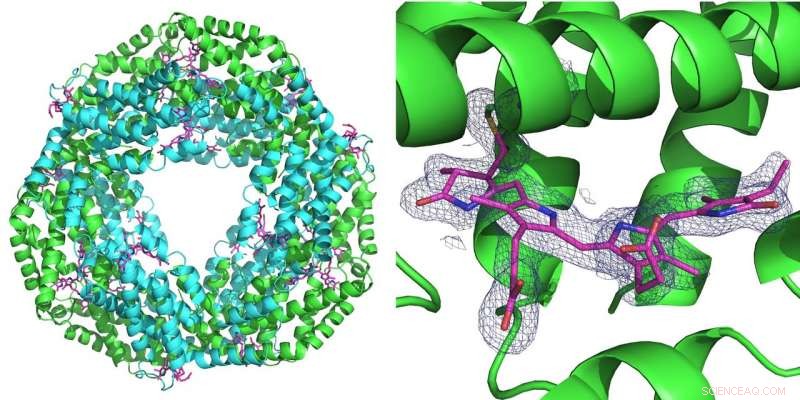
Till vänster:Den första mätningen som genomfördes med den nya uppsättningen gjordes på proteinet phycocyanin som spelar en roll för fotosyntesen i cyanobakterier. Den bildar en ring av sex dubbla molekyler (heterodimerer). Vid varje heterodimer kan tre fykocyanobilinmolekyler (rosa) binda. Höger:Det blå rutnätet representerar elektrontätheten för en bunden fykocyanobilinmolekyl. Båda strukturerna beräknades från bara 52 diffraktionsbilder inspelade med den rosa strålen från Advanced Photon Source (APS) vid BioCARS beamline. Kredit:DESY, Julia Lieske
Forskarna har därför kommit med en ny uppsättning, som till stor del dämpar den oönskade spridda strålningen. De använder en provhållare gjord av kisel, som inte sprider röntgenstrålar; också, de säkerställer att det finns mycket lite luft i röntgenstrålens väg. För att uppnå detta, röntgenstrålen är innesluten i ett tunt metallrör precis före och bakom provet, som hindrar den spridda strålningen från att nå röntgenkameran. Också, luften som omedelbart omger provet ersätts med en ström av heliumgas, vilket orsakar mindre spridning än luft. Genom att undertrycka spridd strålning, forskarna har nu för första gången lyckats bestämma den tredimensionella strukturen hos två proteiner med mycket hög precision med hjälp av seriell rosa strålkristallografi vid en synkrotron. Motsvarande mätningar gjordes vid BioCARS-strållinjen för Advanced Photon Source (APS) vid Argonne National Laboratory i USA.
"En stor fördel med denna metod är att den kan användas för att utföra mycket noggranna studier av proteinstrukturer, men kräver bara en bråkdel av provmaterialet, " förklarar Meents från Center for Free Electron Laser Science (CFEL) ett samarbete med DESY, universitetet i Hamburg och tyska Max Planck Society.. "Omvänt, den lilla provstorleken och metodens hastighet gör att väldigt många mätningar kan göras på kort tid, till exempel inom läkemedelsforskning, där man skulle vilja veta vilka potentiella aktiva substanser som binder till ett specifikt protein som är involverat i en sjukdom." den nya metoden kräver mycket mindre tid för att genomföra hela experimentet, vilket kommer att möjliggöra högkapacitetsmätningar av kristallstrukturer.
Vidare, eftersom mätningar kan utföras vid rumstemperatur, strukturella förändringar som de som uppstår när en aktiv substans binder till ett målprotein kan i framtiden studeras över tid. Den nya metoden uppnår en mycket hög tidsupplösning på 100 pikosekunder, något som inte var möjligt vid synkrotroner med de monokromatiska röntgenstrålar som användes förr. En pikosekund är en miljondels miljondels sekund. En ljusstråle färdas cirka tre centimeter på 100 pikosekunder.