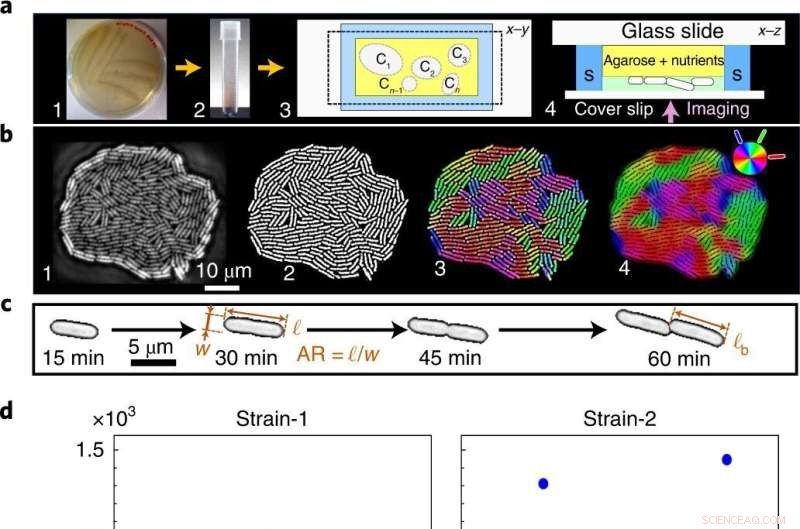
Från bullriga fenotyper till en statistiskt exakt övergångshändelse från mono-till-flerlager. a , Celler strukna på näringsrik agarplatta (1) överförs till det flytande mediet (2), sås sedan i mikrofluidkammaren, här Ci betecknar individuella kolonier (3), för faskontrast time-lapse avbildning (4) i simbassängen (S). b , Råbilder av växande kolonier (1) binariseras för att extrahera fenotypiska egenskaper (2) och färgkodas för att visualisera lokal cellorientering (3,4). c , Encelliga geometriska egenskaper:AR och ℓ b . d ,e , A c är oberoende av tillväxttemperaturen (d ), vilket avslöjas både i vår teori och experiment, medan t c är temperaturberoende (e ). Blå och röda punkter indikerar distinkta biologiska replikat (inklusive flera tekniska replikat) för A c och t c experimentella data. A c har stor varians över alla T , medan t c har låg varians, vilket minimerar ytterligare med tillväxttemperaturen. f , Egenskapsspecifikt fenotypiskt brus, kvantifierat som den normaliserade variansen, F = var(⋯)/〈⋯〉 2 , över T :ℓ b (blå rutor), A c (röda trianglar), celllängds dubbleringstid τ sc (svarta diamanter), AR (magenta trianglar) och t c (gröna cirklar). Trots det höga fenotypiska bruset på individuella skalor (ℓ b , AR och τ sc ), t c är statistiskt exakt (motsvarande brus är storleksordningar lägre över alla T ). Felstapeln anger standardavvikelsen för F över kolonier. Kredit:Naturfysik (2022). DOI:10.1038/s41567-022-01641-9
Bakterier samarbetar och koordinerar kollektivt eftersom de bildar en gemensam struktur som kallas en biofilm, till exempel tandplacket på våra tänder eller mikrobiomet som är associerat med vår tarm. Denna självorganisering i flera komplexa lager – trots variationer av cellulära egenskaper på individuell nivå – kräver att de levande systemen delar gemensam, men ändå exakt tid, som nu har avslöjats av fysiker från universitetet i Luxemburg.
Prof. Anupam Sengupta och hans team förklarade detta genom att zooma in på tillväxten och utvecklingen av begynnande bakteriella biofilmer, där de upptäcker framväxande korssamtal mellan biofysiska egenskaper som möjliggör exakt timing av strukturella, topologiska och hydrodynamiska övergångar på populationsskala. De banbrytande fynden visas i den senaste upplagan av tidskriften Nature Physics .
Bakteriella biofilmer finns på nästan alla naturliga och konstgjorda ytor vi stöter på. De är avgörande för människans existens:från de i tarmen som reglerar vårt fysiska välbefinnande, till de som reglerar utvecklingen av cancer och håller vårt ekosystem i balans. Tack vare de utsökta fysikalisk-kemiska återkopplingsmekanismerna som förmedlar deras produktiva ytrelaterade livsstilar, är biofilmer mycket motståndskraftiga och kan kolonisera olika system.
Nyligen genomförd encellsforskning av prof. Sengupta och medarbetare har avslöjat avgörande roller som encellsgeometri och tillväxtdynamik spelar för att forma de dynamiska egenskaperna hos växande bakterieskikt. Ändå har hur variationer i statistik på cellnivå – en helt outredd aktör i existerande modeller för levande och aktiv materia – påverkar framväxande kollektiva fenomen i bakteriella biofilmer förblivit en utmaning, och därmed till stor del outforskade.
Nu löser forskare från Physics of Living Matter Group vid University of Luxembourg denna långvariga gåta:hur biofilmer – och levande system i allmänhet – reglerar tidpunkten för viktiga utvecklingshändelser som uppstår från individer med mycket varierande och dynamiska attribut. Med ett kvantitativt tvärvetenskapligt tillvägagångssätt för att spionera inom begynnande bakteriella biofilmer, tillhandahåller Prof. Senguptas team den mekanistiska underbyggnaden av hur vältajmade utvecklingssteg uppstår kollektivt på grund av självregleringen av egenskaper på cellnivå, som korssamtal för att mildra varje andras bullriga effekter, vilket i slutändan möjliggör en exakt timing av viktiga utvecklingshändelser.
Arbetet dyker djupare in i att rationalisera resultaten, vilket ger en fysiologiskt konsekvent bild baserad på de metaboliska kraven under de tidiga stadierna av biofilmutveckling. Resultaten visar hur självreglering av fenotypiskt brus driver vältajmade övergångar i struktur, topologi och aktiva flöden i bakteriekolonier, vilket belyser fysikens strategiska roll för att förstå biologiska system. Arbetet passar brett in i Physics Meets Biology-initiativet inom universitetet i Luxemburg.
Brusiga fenotyper driver vältajmade utvecklingshändelser
Trots variationen i fenotypiska egenskaper, såsom cellgeometri, tillväxthastigheter och ytassociation, genomgår bakteriella biofilmer kritiska utvecklingssteg i sin livscykel vid exakta tidpunkter, med början med mono-till-flerlagerövergången (MTMT). Efter denna viktiga strukturella övergång sätts en framväxande kaskad igång, som synkront tidsbestämmer förändringarna i topologi och aktiva flödesfält inom och i närheten av de begynnande biofilmerna.
Katalogen nyckelfenotypiska egenskaper hos Escherichia coli och Serratia marcescens som växer under olika förhållanden (näringsnivåer och temperaturer), vilket möjliggör noggrann kontroll av den biologiska aktiviteten och kvantifierar hur korssamtalen mellan fenotypiska ljud bestämmer aktualiteten av strukturell organisation och uppkomsten av aktiva lokala transporter. Detta arbete skapar således den första direkta, mekanistiska kopplingen mellan aktivitetsberoende cellnivåvariabilitet och framväxande egenskaper i populationsskala i levande system.
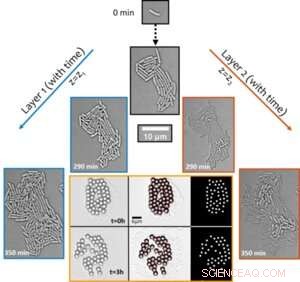
Figur 1. Strukturell övergång av begynnande biofilmer från mono- till multilager driver framväxande synkron transport runt kolonin. Det aktiva transportfenomenet avslöjades genom att visualisera förskjutning av mikronstora partiklar över tiden (visas i den sexpanelsbildade bilden med orange kant). Kredit:University of Luxembourg
Att utnyttja ett tvärskaleligt och tvärvetenskapligt tillvägagångssätt
Med hjälp av en kombination av encells-time-lapse-avbildning, partikelbildhastighet, numeriska simuleringar och kontinuummodellering, kvantifierar teamet cellnivåvariabilitet i termer av fenotypiskt brus och avslöjar avvägningar som i slutändan undertrycker variabilitet i framväxande egenskaper och återger dem synkron. Närmare bestämt, en avvägning mellan bruset i cellgeometrin och tillväxthastigheten självreglerar tidpunkten för mono-till-flerskiktsövergången (MTMT), ett nyckelsteg i biofilmsinitiering, vilket sätter igång en synkron aktiv hydrodynamisk kaskad som driver i slutändan förbättrad lokal transport runt de sammanflytande bakteriekolonierna.
Anmärkningsvärt, trots att arterna är icke-rörliga till sin natur, utlöser den tillväxtberoende aktiva hydrodynamiken inom sammanflytande kolonier lokala flöden i deras omgivning som är starka nog att störa självmonterade partikelkluster (används som spårämnen, se figur 1) och transportera dem aktivt i den mikrobiella miljön. Förbättringen av transport - i en annars diffusionsbegränsad miljö - med mer än två storleksordningar tyder på biologiska funktioner hos sådana aktiva flöden i transporten av molekylär och mikrolast under de tidiga stadierna av biofilmutveckling.
Detta arbete presenterar ett genombrott inom området för fysik av mikrobiell aktiv materia, och ger ett nytt paradigm för att förstå hur sammanflytande bakteriepopulationer kan klara av miljövariationer, inklusive de som påtvingas av livsstil och klimatförändringar, genom att utnyttja deras individuella variationer.
Perspektiv på den synkrona aktiva transporten i begynnande biofilmer
Teamet visar att fastsittande kolonier kan generera och utnyttja aktiva flöden för att transportera biologiska laster av submikron till mikronstorlek som är allmänt associerade med bakteriekolonier. Sammantaget de tillhörande mikrolasternas spännvidden sträcker sig från tiotals nanometer till några mikrometer. Typisk mikrolast inkluderar bakterieceller (olika bärar- och lastarter av mikronstorlek), svampsporer i mikronskala; liposomer och extracellulära vesiklar som levererar genetisk eller biokemisk last (tiotals till hundratals nanometer i storlek), liftande bakteriofager (hundratals nanometer) och syntetiska pärlor och kapslar som är relevanta för läkemedelstillförsel (sub-mikron till tiotals mikron i storlek).
Den biologiska betydelsen av det tidssynkrona sambandet mellan struktur-flöde-transport är flerdelad:Strikt timing av extruderingshändelserna presenterar MTMT som en biofysisk proxy till kvorumliknande avkänning mellan kolonierna, med potentiella konsekvenser av och i synkront urval för resistenta celler (till exempel mot antibiotika). Att störa den väldefinierade MTMT-timingen (till exempel genom att anpassa miljöfaktorer på lämpligt sätt) skulle kunna erbjuda framtida alternativ för att hämma kvorumavkänning och därigenom reglera bakteriell resistens mot antibiotika.
Framöver kommer det att vara avgörande att förstå hur fastsittande kolonier utnyttjar den väldefinierade kritiska tiden för att ställa in kommunikation mellan kolonier under stressiga miljöer (i parameterutrymmet för inre brus och struktur-flödes-tidssynkronicitet). De brusmedierade rums-temporala fenomenen som presenteras i detta arbete ger viktiga saknade insikter i den utvecklingsbiofysiska morfogenesen i system med högre komplexitet, inklusive polymikrobiella konsortier som observerats i människans och växternas mikrobiomer, och multicellulära vävnadssystem som är relevanta för embryonal och cancer progression.
Detta arbete öppnar nya forskningsvägar inom områdena fysik av mikrobiell aktiv substans, mjuk och biologisk fysik, och cellbiologi, och - på grund av den viktiga roll som bakteriella biofilmer har i mänsklig mikrobiome och miljöekologi - även biomedicinska och biotekniska vetenskaper. De strukturella och multifield topologiska resultaten som presenteras här genom Prof. Senguptas vision kommer att vara konsekventa för olika konfluenta system som spänner över aktiva vävnads- och cellsystem, och ett brett utbud av organoidmodeller.
Slutligen tillhandahåller detta arbete ett nytt experimentellt modellsystem för forskning om aktiv materia där passiva enheter samexisterar med aktiva agenter, och inspirerar en ny klass av teoretiska modeller som inkluderar cellulär variabilitet och avvägningar däri för att förstå effekterna av brus, en inneboende biofysisk variabel, om framväxande egenskaper i levande system. + Utforska vidare