Kredit:Jason Drees, Biodesigninstitutet vid ASU
Genom att använda DNA-molekyler som en byggnadsställning, Arizona State University forskare, i samarbete med kollegor vid University of Michigan, har utvecklat en 3-D artificiell enzymkaskad som efterliknar en viktig biokemisk väg som kan visa sig viktig för framtida biomedicinska och energitillämpningar.
Resultaten publicerades i tidskriften Naturens nanoteknik . Leds av ASU-professor Hao Yan, forskargruppen inkluderade forskare från ASU Biodesign Institute Jinglin Fu, Yuhe Yang, Minghui Liu, Professor Yan Liu och professor Neal Woodbury tillsammans med kollegor professor Nils Walter och postdoktor Alexander Johnson-Buck vid University of Michigan.
Forskare inom området DNA-nanoteknik, dra fördel av de bindande egenskaperna hos de kemiska byggstenarna i DNA, vrid och självmontera DNA till allt mer fantasifulla 2- och 3-dimensionella strukturer för medicinska, elektroniska och energitillämpningar.
I det senaste genombrottet, forskargruppen antog utmaningen att efterlikna enzymer utanför cellens vänliga gränser. Dessa enzymer påskyndar kemiska reaktioner, används i våra kroppar för att smälta maten till socker och energi under människans ämnesomsättning, till exempel.
"Vi ser till naturen för inspiration för att bygga konstgjorda molekylära system som efterliknar de sofistikerade maskinerierna i nanoskala som utvecklats i levande biologiska system, och vi designar rationellt molekylära nanoställningar för att uppnå biomimik på molekylär nivå, " sa Yan, som innehar Milton Glick-stolen i ASU Department of Chemistry and Biochemistry och leder Center for Molecular Design and Biomimicry vid Biodesign Institute.
Med enzymer, alla rörliga delar måste vara hårt kontrollerade och koordinerade, annars fungerar inte reaktionen. De rörliga delarna, som inkluderar molekyler som substrat och kofaktorer, allt passar in i en komplex enzymficka precis som en baseboll i en handske. När alla kemiska delar har hittat sin plats i fickan, energin som styr reaktionen blir gynnsam, och snabbt få kemin att hända. Varje enzym frisätter sin produkt, som en batong som lämnas ut i ett stafettlopp, till ett annat enzym för att utföra nästa steg i en biokemisk väg i människokroppen.
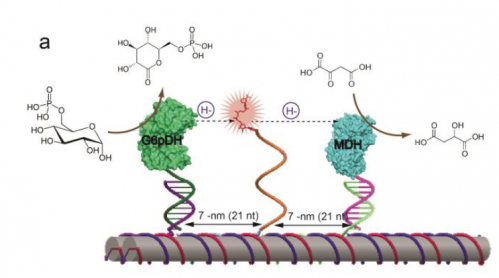
För den nya studien, forskarna valde ett par universella enzymer, glukos-6 fosfatdehydrogenas (G6pDH) och malatdehydrogenas (MDH), som är viktiga för biosyntesen – att göra aminosyrorna, fetter och nukleinsyror som är nödvändiga för allt liv. Till exempel, defekter som finns i vägen orsakar anemi hos människor. "Dehydrogenasenzymer är särskilt viktiga eftersom de levererar det mesta av energin i en cell", sa Walter. "Att arbeta med dessa enzymer kan leda till framtida tillämpningar inom grön energiproduktion som bränsleceller som använder biomaterial för bränsle."
I vägen, G6pDH använder glukossockersubstratet och en kofaktor som kallas NAD för att ta bort väteatomer från glukos och överföra till nästa enzym, MDH, att fortsätta och göra äppelsyra och generera NADH i processen, som används för som en nyckelkofaktor för biosyntes.
Att göra om detta enzympar i provröret och få det att fungera utanför cellen är en stor utmaning för DNA-nanotekniken.
Kredit:ASU Biodesign Institute / Naturens nanoteknik .
För att möta utmaningen, de gjorde först en DNA-ställning som ser ut som flera pappershandduksrullar limmade ihop. Med hjälp av ett datorprogram, de kunde anpassa de kemiska byggstenarna i DNA-sekvensen så att byggnadsställningen skulle självmontera. Nästa, de två enzymerna fästes vid ändarna av DNA-rören.
I mitten av DNA-ställningen, de fäste en enkel DNA-sträng, med NAD+ bunden till slutet som en boll och ett snöre. Yan refererar till detta som en svängande arm, som är lång, flexibel och skicklig nog att gunga fram och tillbaka mellan enzymerna.
När systemet väl gjordes i ett provrör genom att värma upp och kyla DNA, vilket leder till självmontering, enzymdelarna tillsattes. De bekräftade strukturen med hjälp av ett kraftfullt mikroskop, kallas AFM, som kan se ner till nanoskala, 1, 000 gånger mindre än bredden på ett människohår.
Liksom arkitekter, forskarna byggde först en fullskalig modell så att de kunde testa och mäta den rumsliga geometrin och strukturerna, inklusive i deras uppsättning ett litet fluorescerande färgämne fäst på den svängande armen. Om reaktionen äger rum, de kan mäta en röd signal som färgämnet avger — men i det här fallet, till skillnad från en trafiksignal, ett rött ljus betyder att reaktionen fungerar.
Nästa, de provade enzymsystemet och fann att det fungerade precis som en cellulär enzymkaskad. De mätte också effekten när man varierade avståndet mellan den svängande armen och enzymerna. De fann att det fanns en söt plats, vid 7nm, där armvinkeln var parallell med enzymparet.
Med en enda svängande arm i provrörssystemet fungerar precis som de cellulära enzymerna, de bestämde sig för att lägga till vapen, testa systemets gränser med upp till 4 tillagda armar. De kunde visa att när varje arm lades till, G6pDH skulle kunna hänga med för att göra ännu mer produkt, medan MDH hade maxat efter bara två svängande armar. "Att lägga enzymer längs en designad löpande band som Henry Ford gjorde för bildelar är särskilt tillfredsställande för någon som bor nära motorstaden Detroit, sa Walter.
Arbetet öppnar också en ljus framtid där biokemiska vägar kan replikeras utanför cellen för att utveckla biomedicinska applikationer som detektionsmetoder för diagnostiska plattformar.
"Ett ännu högre och mer värdefullt mål är att konstruera högt programmerade kaskad-enzymvägar på DNA-nanostrukturplattformar med kontroll av in- och utdatasekvenser. Att uppnå detta mål skulle inte bara göra det möjligt för forskare att härma de eleganta enzymkaskader som finns i naturen och försöka förstå deras underliggande verkningsmekanismer, men skulle underlätta konstruktionen av konstgjorda kaskader som inte finns i naturen, " sa Yan.