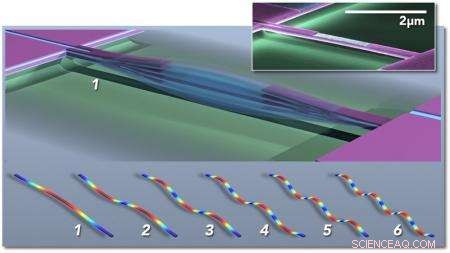
Multimode nanoelektromekaniska system (NEMS) baserad masssensor; huvudfiguren visar schematiskt en dubbelklämd stråle som vibrerar i grundläge (1). Konceptuella "ögonblicksbilder" av de första sex vibrationslägena visas nedan (1-6), färger indikerar hög (röd) till låg (blå) belastning. Insatsen visar ett färgat elektronmikrofoto av en piezoelektrisk NEMS-resonator tillverkad i Caltechs Kavli Nanoscience Institute. Kredit:M. Matheny, L.G. Villanueva, P. Hung, J. Li och M. Roukes/Caltech
Bygger på deras skapelse av den första mekaniska enheten någonsin som kan mäta massan av enskilda molekyler, en i taget, ett team av Caltech-forskare och deras kollegor har skapat nanoenheter som också kan avslöja deras form. Sådan information är avgörande när man försöker identifiera stora proteinmolekyler eller komplexa sammansättningar av proteinmolekyler.
"Du kan föreställa dig att med stora proteinkomplex gjorda av många olika, mindre underenheter finns det många sätt för dem att monteras. Dessa kan i slutändan ha ganska lika massor samtidigt som de faktiskt är olika arter med olika biologiska funktioner. Detta gäller särskilt med enzymer, proteiner som medierar kemiska reaktioner i kroppen, och membranproteiner som kontrollerar en cells interaktion med dess miljö, " förklarar Michael Roukes, Robert M. Abbey professor i fysik, Tillämpad fysik, och Bioengineering på Caltech och den medförfattare till en artikel som beskrev tekniken som dök upp den 30 mars i tidskriftens onlineutgåva Naturens nanoteknik .
En grund för genomikrevolutionen har varit förmågan att replikera DNA- eller RNA-molekyler i massor med hjälp av polymeraskedjereaktionen för att skapa de många miljoner kopior som krävs för typisk sekvensering och analys. Dock, samma massproduktionsteknik fungerar inte för att kopiera proteiner. Just nu, om du vill identifiera ett visst protein korrekt, du behöver mycket av det - vanligtvis miljontals kopior av bara proteinet av intresse, med mycket få andra främmande proteiner som föroreningar. Den genomsnittliga massan av denna molekylära population utvärderas sedan med en teknik som kallas masspektrometri, där molekylerna joniseras – så att de får en elektrisk laddning – och sedan får interagera med ett elektromagnetiskt fält. Genom att analysera denna interaktion, forskare kan härleda förhållandet mellan molekylmassa och laddning.
Men masspektrometri kan ofta inte urskilja subtila men avgörande skillnader i molekyler som har liknande förhållande mellan massa och laddning. "Med masspektrometri idag, " förklarar Roukes, "Stora molekyler och molekylära komplex skärs först upp i många mindre bitar, det är, till mindre molekylfragment som befintliga instrument kan hantera. Dessa olika fragment analyseras separat, och sedan bioinformatik – som involverar datorsimuleringar – används för att lägga ihop pusslet igen. Men denna återmonteringsprocess kan motverkas om delar av olika komplex blandas ihop."
Med sina enheter, Roukes och hans kollegor kan mäta massan av en enskild intakt molekyl. Varje enhet - som bara är ett par miljondelar av en meter i storlek eller mindre - består av en vibrerande struktur som kallas en nanoelektromekaniskt system (NEMS) resonator. När en partikel eller molekyl landar på nanoenheten, den tillförda massan ändrar frekvensen med vilken strukturen vibrerar, ungefär som att lägga loddroppar på en gitarrsträng skulle ändra frekvensen av dess vibration och resulterande ton. De inducerade skiftningarna i frekvens ger information om partikelns massa. Men de också, som beskrivs i den nya tidningen, kan användas för att bestämma den tredimensionella rumsliga fördelningen av massan:d.v.s. partikelns form.
"En gitarrsträng vibrerar inte bara vid en frekvens, " säger Roukes. "Det finns övertoner i dess grundton, eller så kallade vibrationslägen. Det som skiljer en fiolsträng från en gitarrsträng är egentligen de olika inblandningarna av dessa olika övertoner i grundtonen. Detsamma gäller här. Vi har en hel massa olika toner som kan exciteras samtidigt på var och en av våra nanoenheter, och vi spårar många olika toner i realtid. Det visar sig att när molekylen landar i olika orienteringar, dessa övertoner skiftas annorlunda. Vi kan sedan använda tröghetsavbildningsteorin som vi har utvecklat för att rekonstruera en bild i rymden av molekylens form."
"Den nya tekniken avslöjar en tidigare orealiserad förmåga hos mekaniska sensorer, " säger professor Mehmet Selim Hanay vid Bilkent University i Ankara, Kalkon, en före detta postdoktor i Roukes lab och medförfattare till artikeln. "Tidigare har vi identifierat molekyler, såsom antikroppen IgM, baserat enbart på deras molekylvikter. Nu, genom att möjliggöra att både information om molekylvikt och form kan härledas för samma molekyl samtidigt, den nya tekniken kan avsevärt förbättra identifieringsprocessen, och detta är av betydelse både för grundforskningen och läkemedelsindustrin."
För närvarande, molekylära strukturer dechiffreras med hjälp av röntgenkristallografi, en ofta mödosam teknik som involverar isolering, renande, och sedan kristalliserande molekyler, och sedan utvärdera deras form baserat på de diffraktionsmönster som produceras när röntgenstrålar interagerar med atomerna som tillsammans bildar kristallerna. Dock, många komplexa biologiska molekyler är svåra om inte omöjliga att kristallisera. Och, även när de kan kristalliseras, den erhållna molekylstrukturen representerar molekylen i kristallint tillstånd, som kan skilja sig mycket från strukturen hos molekylen i dess biologiskt aktiva form.
"Du kan föreställa dig situationer där du inte vet exakt vad du letar efter - där du är i upptäcktsläge, och du försöker lista ut kroppens immunsvar mot en viss patogen, till exempel, " säger Roukes. I dessa fall, förmågan att utföra en-molekyldetektion och att få så många separata informationsbitar som möjligt om den enskilda molekylen förbättrar avsevärt chanserna att göra en unik identifiering.
"Vi säger att cancer börjar ofta med en enda avvikande cell, och vad det betyder är att även om det kan vara en av en mängd liknande celler, det är något unikt med den molekylära sammansättningen av den ena cellen. Med denna teknik, vi har potentiellt ett nytt verktyg för att ta reda på vad som är unikt med det, " han lägger till.
Än så länge, den nya tekniken har validerats med hjälp av partiklar av kända storlekar och former, såsom polymer nanodroppar. Roukes och kollegor visar att med dagens toppmoderna nanoenheter, tillvägagångssättet kan ge upplösning i molekylär skala – det vill säga, ge förmågan att se de molekylära delkomponenterna hos individen, intakta proteinsammansättningar. Gruppens nuvarande ansträngningar är nu inriktade på sådana utforskningar.
Scott Kelber, en före detta doktorand i Roukes labb, är den andra medförsta författaren till tidningen, med titeln "Tröghetsavbildning med nanoelektromekaniska system." Professor John Sader vid University of Melbourne, Australien, och en besökande assistent i fysik på Caltech, är medförfattare. Ytterligare medförfattare är Cathal D. O'Connell och Paul Mulvaney från University of Melbourne. Arbetet finansierades av National Institutes of Health Director's Pioneer Award, en Caltech Kavli Nanoscience Institute Distinguished Visiting Professorship, Fondation pour la Recherche et l'Enseignement Superieur i Paris, och Australian Research Councils bidragssystem.