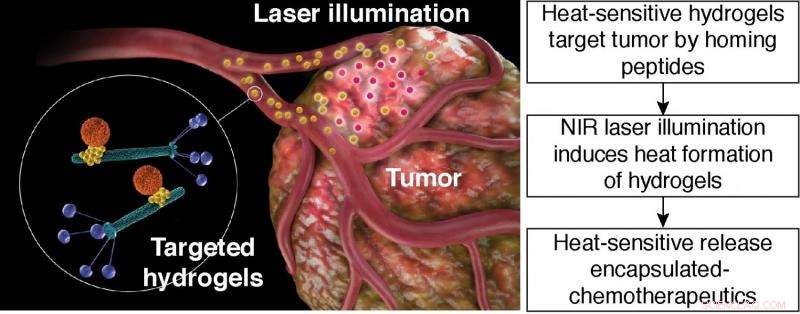
Värmekänslig frisättning av inkapslade kemoterapeutika. Schematisk illustration av riktad hydrogel fototermisk terapi. Riktad hydrogel:orange partikel, liposombaserad nanobärare; gul partikel, Guld nanopartikel; gröna stavar, bakteriofagpartiklar med peptidligander som visas på fagbeläggningsproteinet (blått). Kredit:Hosoya, et al.
(Phys.org)—Funktionaliserade nanopartiklar är en väg för läkemedelsleverans för kemoterapeutika. Dock, att få nanopartiklar att rikta in sig på tumörplatsen har visat sig vara svårt att göra. En metod som forskare har använt för att rikta in sig på cancerceller är att skapa hydrogeler gjorda av filamentös bakteriofag (fag) och guldnanopartiklar. Peptidbindande ligander kan inkorporeras i fagdelen av hydrogelen som sedan kommer att rikta in sig på kända karcinomceller.
En tvärvetenskaplig grupp forskare från olika universitet i Japan, USA., och Tyskland har utvecklat en hydrogelplattform som kan rikta in sig på tumörer, tillhandahålla icke-invasiv bildbehandling, och frisätter ett kemoterapeutiskt läkemedel. De har visat sin plattform i både in vitro-studier och i musmodeller. Dessutom, de visar att deras plattform är generaliserbar till olika mål och kemoterapeutika. Deras arbete visas i Proceedings of the National Academy of Sciences .
Hosoya, et al.s hydrogelplattform består av bakteriofag, guld nanopartiklar, och bärare i nanostorlek såsom liposomer eller mesopourösa kiseldioxidpartiklar. I den här inställningen, fagpartiklar kan känna igen specifika molekyler på tumörcellerna. Guldnanopartiklarna fungerar som en "reporter" för distributionen av hydrogelen. Nanobäraren transporterar olika kemikalier eller läkemedelsgods. Nanobäraren frigör last vid en specifik stimulans, såsom värme.
I det pågående arbetet, Hosoya, et al. visade först att värmekänsliga liposomer (HSL) skulle fungera som en formidabel värmekänslig bärare. I teorin, när HSL börjar smälta, det frisätter läkemedlet som är inkorporerat i det. Använder calcein, en fluorescerande aktiv molekyl, de fastställde att HSL frigjorde kalcein när de nådde 40 o C, som förutspått. När HSL lämnades vid en konstant temperatur (42 o C), det frigjorde allt kalcein inom 10 minuter. Hosoya, et al. visade sedan att dessa HSL fortfarande var känsliga för förändringar i temperatur när de införlivades i hydrogelplattformen.
Nästa steg var att visa att de HSL-innehållande hydrogelerna svarade på NIR-uppvärmning medan de var inne i en matris. Författarna använde agarosgel som sitt modellsystem. De fann att den HSL-innehållande hydrogelen svarade på NIR-uppvärmning och när lasereffekten ökade, temperaturen på hydrogelen ökade. De bestämde sedan om NIR-uppvärmning skulle utlösa frisättningen av doxorubicin (dox), ett kemoterapeutiskt medel. De kunde producera en "reproducerbar och robust fotondosberoende ökning av fluorescensintensitet."
För att bestämma värmefördelningen i hydrogelen från NIR, de använde magnetisk resonanstemperaturavbildning på de HSL-innehållande hydrogelerna på agarosplattformen. De termiska gradientbilderna bekräftade att den centraliserade värmen producerades av hydrogelen via NIR-lasern. De använde gadoliniuminkapslade HSL-innehållande hydrogeler för att bekräfta att läkemedelsfrisättning inträffade vid platsen för laserstrålen.
Även om dessa resultat visar att läkemedelsfrisättning kan kontrolleras med hjälp av NIR, de behöver fortfarande testa om systemet kan rikta in sig på cancerplatsen. Att göra detta, Hosoya, et al inkorporerade en ligand som har en väletablerad cyklisk peptid som binder till CRKL. CRKL-bindande fagpartiklar mål EF43. fgf-4 bröstkarcinomceller. Använder rhodamin-märkta HSL-innehållande hydrogeler, de visade att fagen riktade sig mot karcinomcellerna, bekräftar att det fortfarande bibehåller sina bindningsegenskaper även när det ingår i nanoplattformen.
De gjorde sedan in vivo-testning på möss. De spårade platsen och effekterna av deras HSL-innehållande hydrogelplattform hos möss som hade EF43. fgf-4 bröstcancer. Optiska fluorescensavbildningsstudier visade att tumören var synlig hos möss som behandlats med det riktade hydrogelsystemet jämfört med kontroller. Analys av tumörerna efter 24 timmar visade att guldnanopartiklar, riktad fag, och HSLs var lokaliserade i tumören. Ytterligare studier för att se om deras system sedan kunde frigöra ett kemoterapeutiskt medel med hjälp av NIR på tumörstället visade sig också vara framgångsrika. Författarna observerade minskad tumörtillväxt hos möss med HSL-innehållande hydrogeler med dox, och bekräftade deras resultat med hjälp av matematisk modellering.
Till sist, för att testa mångsidigheten hos deras hydrogel nanoplattform, Hosoya, et al. inkorporerade mesoporösa silikananopartiklar (MSNP) i hydrogelsystemet. MSNP:s kemiska egenskaper möjliggör förpackning av olika kemoterapeutika. De testade om MSNP-innehållande hydrogeler kunde leverera FITC i två olika cancermodeller, samma bröstcancermodell som användes tidigare (EF43. fgf-4 ) och en modell för prostatacancer. De fann riktad bindning till de två cancerformerna och studier med dox visade en minskning av tumörstorleken.
Detta arbete visar en hydrogelplattform som inte ändrar de fysikaliska eller kemiska egenskaperna hos kända nanobärarsystem som värmekänsliga liposomer eller mesoporösa kiseldioxidnanopartiklar. Denna plattform tillåter inriktning, värmeinducerad leverans, och är både mångsidig och reproducerbar. Med ytterligare studier, detta system kan vara ett allmänt, robust metod för riktad läkemedelstillförsel.
© 2016 Phys.org