Nära-infraröd excitation av funktionaliserade vismutferritnanopartiklar resulterar i harmonisk emission som utlöser fotofrisättning av inkapslade molekylära laster, möjliggör frikopplad avbildning och kontrollerad leveranstillämpningar. Kredit:S. Gerber/EPFL
Teranostik är ett framväxande medicinområde vars namn är en kombination av "terapeutik" och "diagnostik." Tanken bakom theranostics är att kombinera läkemedel och/eller tekniker för att samtidigt – eller sekventiellt – diagnostisera och behandla medicinska tillstånd, och även övervaka patientens svar. Detta sparar tid och pengar, men kan också kringgå några av de oönskade biologiska effekter som kan uppstå när dessa strategier används separat.
I dag, Teranostikapplikationer använder alltmer nanopartiklar som förenar diagnostiska molekyler och läkemedel till ett enda medel. Nanopartiklarna fungerar som bärare för molekylär "last, "t.ex. ett läkemedel eller en radioisotop till cancerpatienter som genomgår strålbehandling, inriktning på specifika biologiska vägar i patientens kropp, samtidigt som man undviker skador på friska vävnader.
Väl vid sin målvävnad, nanopartiklarna producerar diagnostiska bilder och/eller levererar sin last. Detta är den banbrytande tekniken för "nanotheranostik, " som har blivit ett stort fokus för forskning - om än med många begränsningar att övervinna.
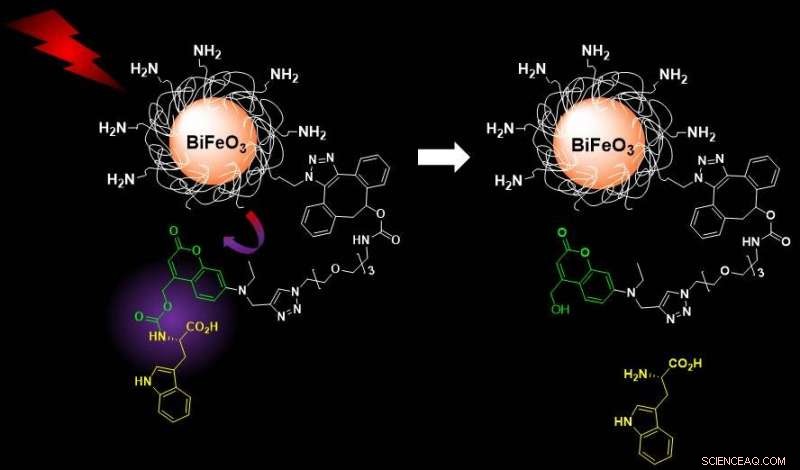
Nu, labbet av Sandrine Gerber vid EPFL, arbetar med fysiker vid universitetet i Genève, har utvecklat ett nytt nanotheranostic system som övervinner flera problem med tidigare tillvägagångssätt. Systemet använder "harmoniska nanopartiklar" (HNPs), en familj av metalloxidnanokristaller med exceptionella optiska egenskaper, särskilt deras emission som svar på excitation från ultraviolett till infrarött ljus, och deras höga fotostabilitet. Det var denna funktion som förde HNP till nanotheranostik, när forskare försökte lösa några problem med fluorescerande sonder.
"De flesta ljusaktiverade nanotheranostiska system behöver UV-ljus med hög energi för att excitera sina fotoresponsiva ställningar, " säger Gerber. "Problemet är att detta resulterar i dåligt penetrationsdjup och kan skada levande celler och vävnader, vilket begränsar biomedicinska tillämpningar."
Det nya systemet som Gerbers grupp utvecklade undviker dessa problem genom att använda kiseldioxidbelagda vismut-ferrit HNP:er funktionaliserade med ljuskänsliga molekylära laster. Dessa system kan enkelt aktiveras med nära-infrarött ljus (våglängd 790 nanometer) och avbildas vid längre våglängder för både detektions- och läkemedelsfrisättningsprocesser. Båda dessa funktioner gör systemet medicinskt säkert för patienter.
När ljuset utlösts, HNP:erna släpper sin last – i det här fallet, L-tryptofan, används som modell. Forskarna övervakade och kvantifierade frisättningen med en teknik som kombinerar vätskekromatografi och masspektrometri, som täcker den bilddiagnostiska delen av det nanotheranostiska systemet.
Författarna konstaterar att "det här arbetet är ett viktigt steg i utvecklingen av nanobärarplattformar som möjliggör frikopplad avbildning i vävnadsdjup och on-demand release av terapeutika."