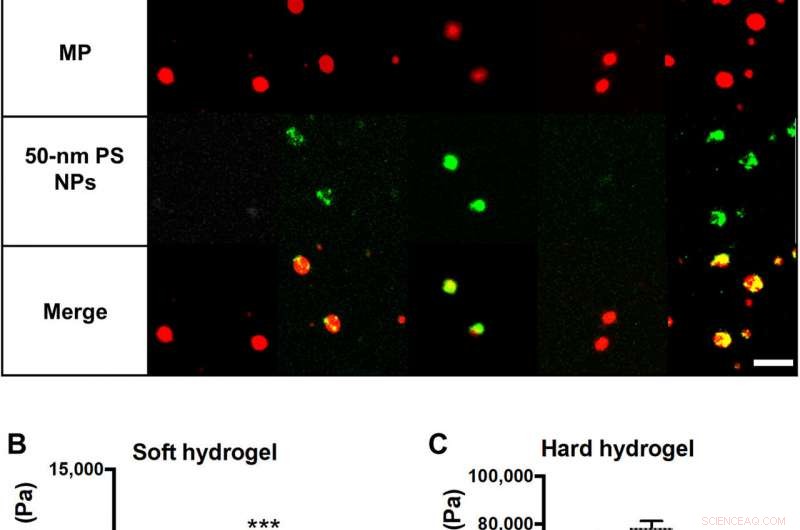
Materialegenskaper hos NP-laddade hydrogel MPs. (A) Schematisk och representativ konfokal mikroskopi fluorescensbilder av hydrogel MP:er utvärderade, med varierad modul och NP-belastning. Rött är MP hydrogel, grönt är 50-nm PS NPs, och de två är överlagrade för att visa samlokalisering av NP:er och hydrogel-MP:er. Skalstång, 5 μm. Svullna skjuvmoduler för (B) 15 % PEG och (C) 50 % PEG-hydrogeler som visar påverkan av att lägga till NP till bulkmaterialreometri. Statistiska analyser utfördes med envägsvariansanalys (ANOVA) med Fishers minst signifikanta skillnad (LSD) test, där (***) indikerar P <0,001 i jämförelse med de icke laddade hydrogelerna. N =3. Felstaplar plottar SE. Kredit:Science Advances, doi:10.1126/sciadv.abe0143
Läkemedelsbärare som riktar sig mot det vaskulära endotelet måste fästa vid endotelets kärlvägg för att uppnå klinisk stabilitet. Partikelstorleken är en kritisk fysisk egenskap för att föreskriva partikelmarginaler inom biologiska blodflöden och de som utförs i laboratoriet. Även om mikropartiklar är optimala för marginalering, nanopartiklar är bättre för intracellulär leverans. I en ny rapport nu på Vetenskapens framsteg , Margaret B. Fish och en forskargrupp inom kemiteknik, farmakologi och kardiovaskulär medicin och teknik vid University of Michigan, Ann Arbor USA, testade flexibla hydrogelpartiklar som bärare för att transportera nanopartiklar till en sjuk vaskulär vägg. Baserat på mikropartikelmodulen, nanopartikelladdade poly(etylenglykol)-baserade hydrogelmikropartiklar levererade mer än 50 nm nanopartiklar till kärlväggen, jämfört med fritt injicerade nanopartiklar för att uppnå mer än 3000 procent ökning i leverans. Arbetet visade fördelen med att optimera effektivitetsmarginalen för mikropartiklar för att förbättra transporten av nanobärare till kärlväggen.
Designa drogbärare
Läkemedelsbärare som riktar sig mot kärlväggen är vanligtvis gjorda av polymera partiklar konstruerade för att fästa vid sjukdomsställen och ackumuleras via markörer på kärlväggen för lokaliserad läkemedelstillförsel. De fysikaliska egenskaperna hos läkemedelsbärare kan bestämma cirkulationstiden, biodistribution, vaskulär vidhäftning och immuninteraktioner. Effektiv vidhäftning av kärlväggen är avgörande för korrekt frisättning av deras läkemedelsnyttolast till den sjuka endotelvävnaden. Även om nanopartiklar (20 till 80 nm i diameter) är en tilltalande läkemedelskandidat, endast mindre än 1 procent når den tänkta platsen. Jämförelsevis, mikropartiklar med 2 till 3 mikrometers diameter verkar vara optimala läkemedelsbärare. Fish et al. undersökte därför möjligheten att ladda nanopartiklar i vaskulärt riktade flexibla mikropartiklar för att övervinna de befintliga gränserna med fria nanopartiklar. Genom att använda nanopartikelladdade hydrogelmikropartiklar, teamet visade den jämförelsevis effektiva leveransen av nanopartiklar till kärlväggen. Detta resultat ger en möjlighet att öka den kliniska användningen av nanopartikelläkemedelsbärare för att behandla vanliga sjukdomar.
Vidhäftning av NP-laddade hydrogel MPs till ett inflammerat HUVEC-monoskikt vid 200 s−1 WSR. (A) Schematisk beskrivning av "fast MP-koncentration" in vitro-flödesexperiment. Kvantifierad (B) vidhäftning för anti-ICAM-1-belagda hydrogel MP:er doserade i blod vid en fast MP-koncentration och skalade till (C) motsvarande antal NP:er som levereras av de vidhäftande hydrogel MP:erna i (B). (D) Schematisk beskrivning av de fria NP-flödesexperimenten in vitro. (E) Antal NP:er som levereras till kärlväggen av fria anti-ICAM-1-belagda PS NP:er doserade vid 3 × 107 NPs/ml eller baserat på (F) vidhäftningen av hydrogel MP:er doserade i blod för att bära en fixerad tre gånger lägre NP-last på 1 × 107 NPs/ml. För alla, adhesion kvantifierades efter 5 min av laminärt blodflöde över ett IL-1β-aktiverat HUVEC-monoskikt. N ≥ 3 humana blodgivare per partikeltillstånd. Statistisk analys av adherentdensitet utfördes med envägs ANOVA med Fishers LSD-test, där (*) anger P <0,05, (**) indikerar P <0,01, (***) indikerar P <0,001, och (****) indikerar P <0,0001 mot den första stapeln i varje plot. Felstaplar plot SE. Kredit:Science Advances, doi:10.1126/sciadv.abe0143 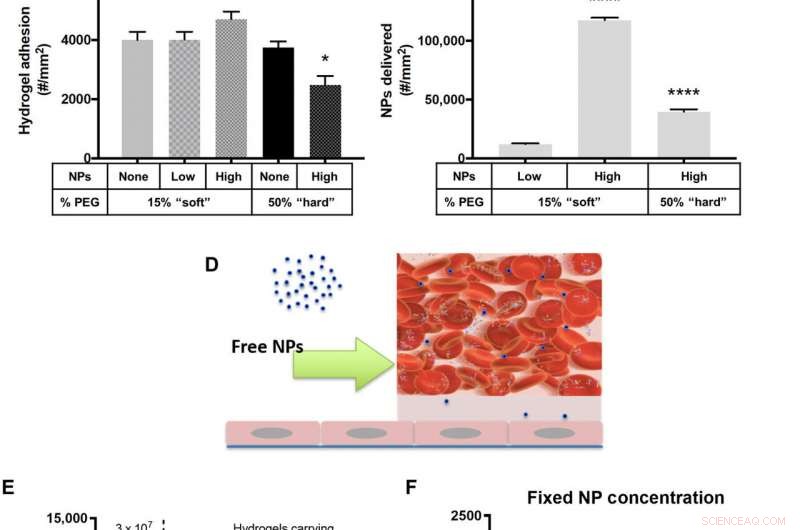
Forskarna försåg först hydrogel-mikropartikelbärarna med polymera nanopartiklar som last. För att åstadkomma detta, de valde polystyren (PS) NPs på grund av deras enhetliga storleksfördelning och konsistensen av NP-belastningar över olika MP-formuleringar. Teamet testade sedan parametrar för partikelvidhäftning för att förstå hur stela polystyrennanopartiklar med en elasticitetsmodul på cirka 2 GPa påverkade hydrogelernas bulkmodul. För detta, de laddade 50-nm polystyren NP i hårda mikropartiklar och noterade ingen signifikant ökning av bulkskjuvmodulen, samt stor flexibilitet. Sedan, Fish et al. testade förmågan hos NP-laddade hydrogelmikropartiklar att binda till en aktiverad human navelvenendotelcell (HUVEC) monolager under mänskligt blodflöde i en kammare med parallella plattor, i labbet. Med hjälp av testanalysen, de kvantifierade antalet nanopartiklar och mikropartiklar som transporterades till kärlväggen. Teamet studerade vidare de laddade hydrogel MPs i förhållande till fria NPs på en plattläsare. Resultaten visade hur läkemedelsbärare med högre NP-belastning levererade en signifikant högre NP-nyttolast till väggen. Baserat på sammansättningen av olika läkemedelsbärarprototyper, Fish et al. noterade att 50 procent polyetylenglykol (PEG) som utgör mikropartiklar har levererat flest nanopartiklar. Jämfört med enbart fria NP, leveransen av hydrogelmikropartiklar uppnådde kvantitativt en 1550-procentig ökning av antalet nanopartiklar för att nå kärlväggen.
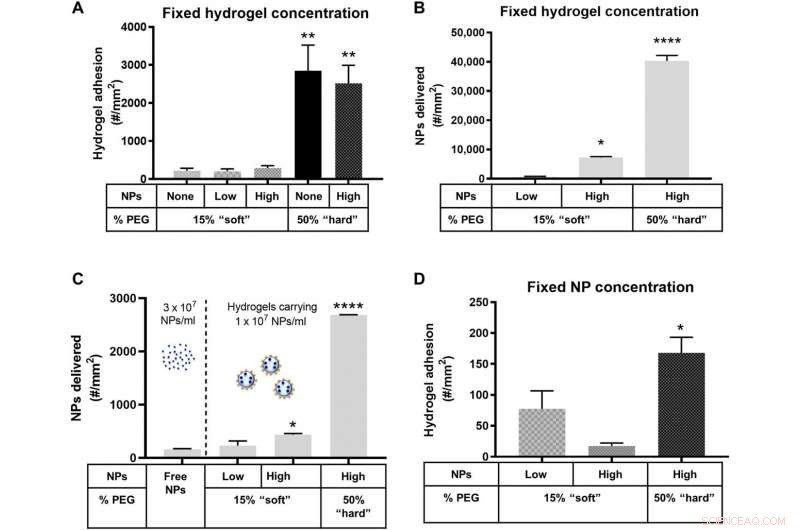
Vidhäftning av NP-laddade hydrogel MPs till ett inflammerat HUVEC-monoskikt vid 1000 s−1 WSR. Kvantifierad (A) vidhäftning för hydrogel MP:er doserade i blod vid en fast MP-koncentration och skalad till (B) motsvarande antal NP:er som levereras av de vidhäftande hydrogel MP:erna i (A). (C) Antal NP:er levererade till kärlväggen av fria anti-ICAM-1-belagda NP:er doserade vid 3 × 107 NPs/ml eller baserat på (D) vidhäftningen av hydrogel MP:er doserade i blod för att bära en fixerad tre gånger lägre NP-last på 1 × 107 NPs/ml. För alla, adhesion kvantifierades efter 5 min av laminärt blodflöde över ett IL-1β-aktiverat HUVEC-monoskikt. N ≥ 3 humana blodgivare per partikeltillstånd. Statistisk analys av adherentdensitet utfördes med envägs ANOVA med Fishers LSD-test, där (*) anger P <0,05, (**) indikerar P <0,01, (***) indikerar P <0,001, och (****) indikerar P <0,0001 mot den första stapeln i varje plot. Felstaplar representerar SE. Kredit:Science Advances, doi:10.1126/sciadv.abe0143
Nanopartikel (NP) kärlväggsbindningsdynamik
Baserat på flera kontrollexperiment, Fish et al. bekräftade sedan hur skillnaden mellan NP:er som levereras till kärlväggar via MP:er kontra fria NP:er, förlitade sig inte bara på att de fria NP:erna binder till blodceller eller fagocyteras av blodleukocyter. För att åstadkomma detta, de utförde flödescytometriexperiment av blodprover som tagits efter flödesanalyser och fann ett obetydligt antal leukocyter bundna av NP. Utöver det, när de inkuberade fria NP i statiska bloduppsättningar i labbet, endast ett mycket minimalt antal blodkroppar band NPs i statiska analyser. Teamet ansåg därför att den låga NP-vidhäftningen berodde på ett misslyckande med att binda till kärlväggen, och inte på grund av deras clearance via fagocytos, inte heller på grund av deras ospecifika bindning till blodkroppar. De genomförde sedan kliniska tester för att jämföra vidhäftningen av NP-laddade MP:er mot fria 50 nm NP:er i mesenterialven hos möss. De valde mesenteriet med akut inflammation för att visualisera partikelvidhäftning med hjälp av intravital mikroskopi. Hydrogel MP:erna var betydligt effektivare när det gäller att leverera 50 nm polystyrennanopartiklar till ett inflammerat mesenterium i den biologiska modellen, jämfört med fria NP, oavsett mängden fria NP som laddas.
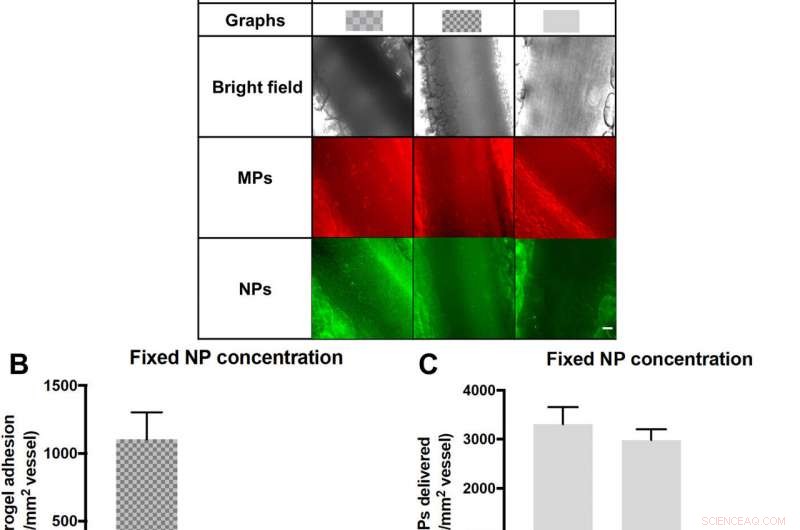
Leverans av NPs till ett inflammerat mesenterialt endotel som en funktion av laddning i hydrogel MPs. (A) Representativa ljusfälts- och fluorescensbilder av partikelvidhäftning till inflammerat mesenterium. n/a, inte tillämpbar. (B) Kvantifierad vidhäftningsdensitet av tre olika partikelförhållanden, 15 % PEG, lågladdande hydrogel MPs, 15 % PEG, högladdande hydrogel MPs, och fria NP. Partiklar doserades med ekvivalent NP-nyttolast. (C) Data skalade till antalet NP som levereras av vidhäftande hydrogel MP för att visa effektiviteten av NP-leverans av varje VTC-system. N =3 möss per grupp, och statistisk analys utfördes med envägs ANOVA med Fishers LSD-test, där (**) indikerar P <0,01 och (***) indikerar P <0,001 jämfört med den låga NP-laddade 15 % PEG. Felstaplar plot SE. Skalstång, 50 μm. Kredit:Science Advances, doi:10.1126/sciadv.abe0143
Uthållig vidhäftning av partiklar i tid.
Medan nanopartiklar är kända för att bibehålla längre cirkulationstider jämfört med partiklar i mikrostorlek, det antas att 50 nm polystyrenpartiklar skulle överträffa MP över tiden. För att förstå detta, teamet bedömde riktad partikelbindningstid genom att undersöka och jämföra tre flexibla partikeltyper direkt med 50 nm polystyrenpartiklarna. De fångade sedan partikelvidhäftning på fem distinkta platser i mesenterialvenen var femte minut under en timme. Under den timslånga ramen, hydrogel-NP:erna matchade eller överträffade inte hydrogel-MP:erna i målinriktad vidhäftningseffektivitet. Teamet undersökte sedan ett längre inriktningsfönster med en akut lungskadamodell och noterade en utökad närvaro av riktad flexibel vidhäftning av hydrogel-MPs in vivo.
Beteende hos riktade hydrogelpartiklar hos möss med akut lungskada. Ackumulering av PEG-baserade (A) 2-μm MPs och (B) 500-nm NPs i lungskada muslungor 2, 4, 8, och 24 timmar efter partikelinjektion. (C och D) Blodcirkulationsprofil över tid i lungskadamöss som visar koncentrationen av PEG-baserade partiklar som finns kvar i blodomloppet hos lungskadamöss minuter efter partikelinjektion. Plots visas för både ICAM-1 riktade (T) och oriktade (U) partiklar. Staplar representerar SE för N =4. Statistisk analys utfördes med envägs ANOVA med Fishers LSD-test, där (*) anger P <0,05 jämfört med den oriktade partikeln vid den tidpunkten. Kredit:Science Advances, doi:10.1126/sciadv.abe0143 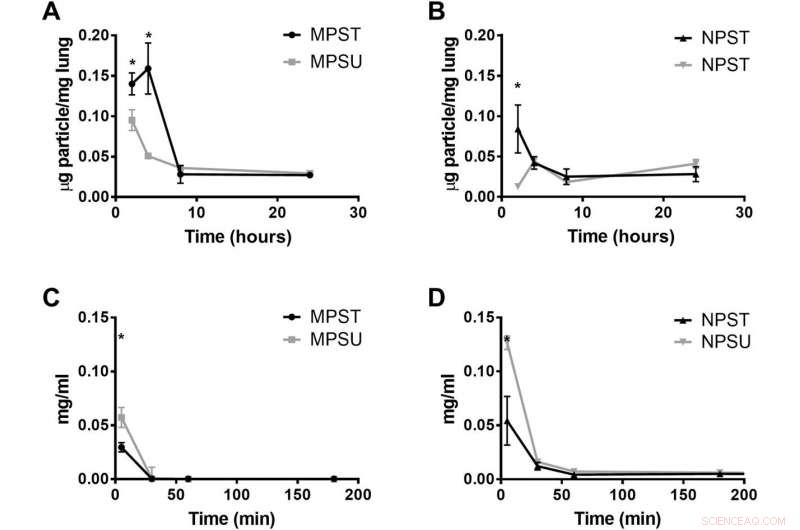
På det här sättet, Margaret B. Fish och kollegor visade hur laddning av nanopartiklar (NP) i hydrogelmikropartiklar (MP) hade utmärkt inflytande på att förbättra leveransen av mindre NP:er för en mängd olika kliniska situationer som är lämpade för riktad läkemedelsleverans. På grund av deras mycket inställbara flexibilitet, teamet kunde designa hydrogelbärarna för att säkerställa enkel transport genom kärlsystemet med låg risk för kärlvslutning vid bindning, ungefär som de inhemska vita blodkropparna. Jämfört med fria NP, de mjuka hydrogel MPs erbjöd betydligt starkare och ihållande vidhäftning, under alla experiment. Detta arbete visade en enorm fördel med att transportera NP till kärlväggen via strategin att ladda NP till hydrogeler och resultatet kan optimeras för kliniska tillämpningar inom regenerativ medicin och bioteknik.
© 2021 Science X Network