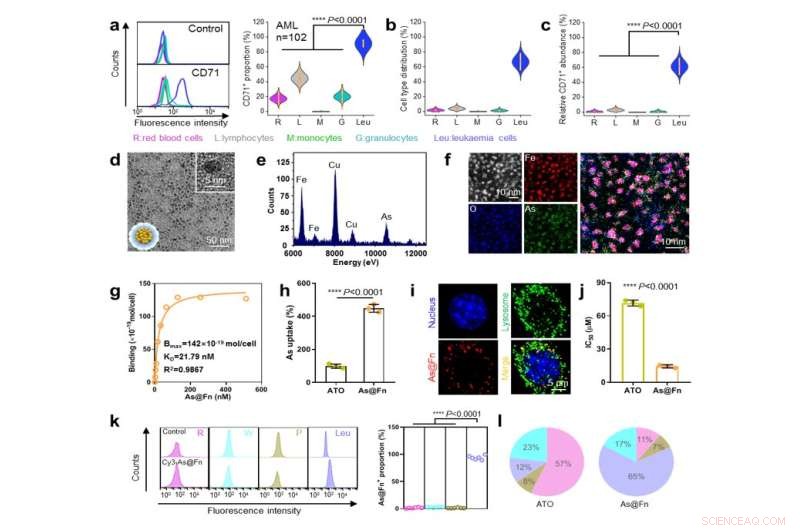
CD71-uttryck på leukemiceller, As@Fn-konstruktion och analys av målförmåga. Kredit:IPE
Forskare från Institute of Process Engineering (IPE) vid den kinesiska vetenskapsakademin, Peking University och Zhujiang Hospital vid Southern Medical University har utvecklat en ferritin (Fn)-baserad nanomedicin för riktad tillförsel av arsenik (As) och effektiv terapi mot olika leukemi typer.
Studien publicerades i Nature Nanotechnology den 25 oktober.
Leukemi är ett allvarligt hot mot människors hälsa, med låga överlevnadssiffror för både vuxna och barn. På kliniken är kemoterapi fortfarande den huvudsakliga terapeutiska modaliteten för alla typer av leukemi och inducerar oundvikligen off-target distribution och toxiska biverkningar.
Riktad leverans av kemoterapeutiska läkemedel till leukemiceller kan lindra toxiska biverkningar och förbättra terapeutiska effekter. Flera nya mål har identifierats på leukemiceller, men deras uttrycksegenskaper varierar mycket för olika typer och förlopp av leukemi.
Genom screening av ett stort antal kliniska prover bekräftade forskarna att patienter med olika former av leukemi visade stabilt och starkt uttryck av CD71. "CD71 kan användas som ett nytt och tillförlitligt mål för utvecklingen av anti-leukemi precisionsterapier", säger professor Li Yuhua vid Zhujiang Hospital.
Som CD71-ligand har Fn en unik kvartär struktur och inre hålighet, vilket är gynnsamt för läkemedelsaccommodation. Med hjälp av en ferrimedierad koordinationsprocess laddades trivalent As (AsIII), den medicinska formen av det kemoterapeutiska läkemedlet arseniktrioxid (ATO), effektivt in i Fn.
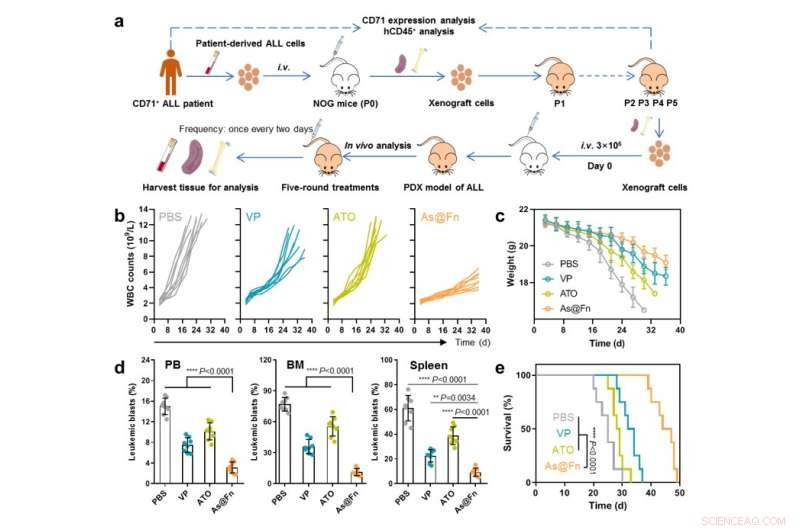
Potent anti-leukemiaktivitet av As@Fn i patienthärledd xenograftmodell. Kredit:IPE
"Laddningsinnehållet är ~200 som i varje Fn och As matchar det kända kliniskt effektiva valenstillståndet för den godkända ATO", säger professor Ma Ding vid Peking University.
As@Fn-formuleringen bibehöll en stark förmåga att binda till olika typer av leukemiceller. Efter internalisering skulle AsIII sedan frisättas i den sura lysosomen.
"Vi är glada över att observera att vår As@Fn nanomedicin avsevärt förbättrade As-ackumuleringen i leukemiceller både in vitro och in vivo", säger professor Wei Wei från IPE. "Sådant målbeteende är gynnsamt för att förbättra den dödande effekten på leukemiceller samtidigt som det minskar toxiciteten för normala vävnader."
När det gäller terapeutisk effekt överträffade As@Fn guldstandarden i olika cellinjehärledda xenograftmodeller, såväl som i en patienthärledd xenograftmodell.
"Denna nanomedicin utökade inte bara det terapeutiska fönstret för As utan utökade också tillämpningen till fler typer av leukemi", säger prof. Ma Guanghui från IPE. "Med tanke på att Fn är ett endogent protein och ATO har godkänts för klinisk användning mot leukemi, har vår nanomedicin potential för klinisk översättning."
En referentgranskare från Nature Nanotechnology sa, "Sammantaget var studien väl genomförd och kontrollerad med en betydande mängd in vitro och in vivo data för att stödja att den nyutvecklade As@Fn som en ny ferritinbaserad As nanomedicin är effektiv för att behandla olika human leukemi." + Utforska vidare