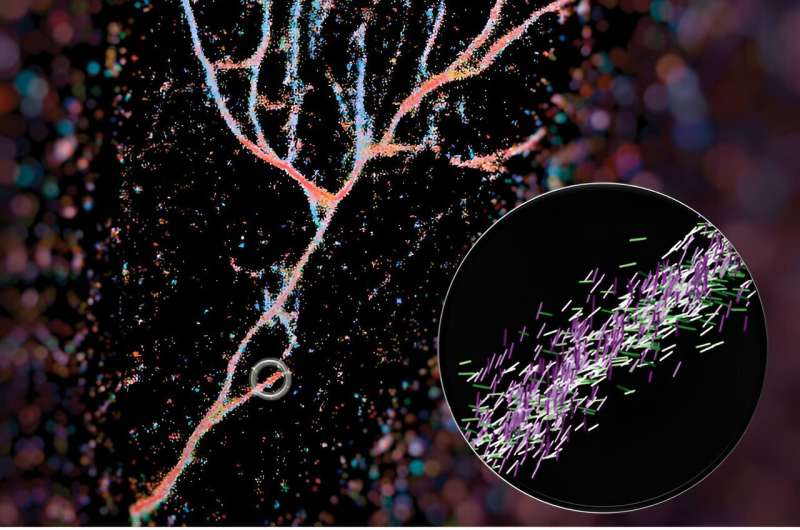
En ny avbildningsteknik som utvecklats av ingenjörer vid Washington University i St. Louis kan ge forskare en mycket närmare titt på fibrillsammansättningar – staplar av peptider som inkluderar amyloid beta, framför allt förknippad med Alzheimers sjukdom.
Dessa kors-β-fibriller är också användbara byggstenar inom designade biomaterial för medicinska tillämpningar, men deras likhet med deras amyloid beta-kusiner, vars härvor är ett symptom på neurodegenerativ sjukdom, är oroande. Forskare vill lära sig hur olika sekvenser av dessa peptider är kopplade till deras varierande toxicitet och funktion, för både naturligt förekommande peptider och deras syntetiskt framställda kusiner.
Nu kan forskare få en tillräckligt nära titt på fibriller för att se att det finns betydande skillnader i hur syntetiska peptider staplas jämfört med amyloid beta. Dessa resultat härrör från ett fruktbart samarbete mellan huvudförfattaren Matthew Lew, en docent i el- och systemteknik, och Jai Rudra, en docent i biomedicinsk teknik, vid WashU:s McKelvey School of Engineering.
"Vi konstruerar mikroskop för att möjliggöra bättre mätningar i nanoskala så att vetenskapen kan gå framåt," sa Lew.
I en artikel publicerad nyligen i ACS Nano , Lew och kollegor beskriver hur de använde den röda kemiska sonden från Nilen för att lysa upp kors-β-fibriller. Deras teknik, som kallas single-molecule orientation-localization microscopy (SMOLM), använder ljusblixtarna från Nilenröda för att visualisera fiberstrukturerna som bildas av syntetiska peptider och av amyloid beta.
Summan av kardemumman:Dessa sammanställningar är mycket mer komplicerade och heterogena än väntat. Det är goda nyheter eftersom det betyder att det finns mer än ett sätt att stapla proteiner på ett säkert sätt. Med bättre mätningar och bilder av fibrillsammansättningar kan bioingenjörer bättre förstå reglerna som dikterar hur proteingrammatik påverkar toxicitet och biologisk funktion, vilket leder till effektivare och mindre toxiska terapier.
Först måste forskare se skillnaden mellan dem, något mycket utmanande på grund av den lilla skalan av dessa sammansättningar.
"Den spiralformade vridningen av dessa fibrer är omöjlig att urskilja med ett optiskt mikroskop, eller till och med vissa superupplösningsmikroskop, eftersom dessa saker är alldeles för små," sa Lew.
Med högdimensionell bildteknik som utvecklats i Lews labb de senaste åren kan de se skillnaderna.
Ett typiskt fluorescensmikroskop använder fluorescerande molekyler som glödlampor för att framhäva vissa aspekter av ett biologiskt mål. När det gäller detta arbete använde de en av dessa sonder, Nile red, som en sensor för vad som fanns runt den. När Nile red slumpmässigt utforskar sin miljö och kolliderar med fibrillerna, avger den ljusblixtar som de kan mäta för att avgöra var den fluorescerande sonden är och dess orientering. Utifrån dessa data kan de sätta ihop hela bilden av konstruerade fibriller som staplas mycket annorlunda än naturliga sådana som amyloid beta.
Deras bild av dessa fibrillsammansättningar gjorde omslaget till ACS Nano och sattes ihop av första författaren Weiyan Zhou, som färgkodade bilden baserat på var de röda Nilen pekade. Den resulterande bilden är en blåröd flödande sammansättning av peptider som ser ut som en floddal.
Forskarna planerar att fortsätta att utveckla tekniker som SMOLM för att öppna nya vägar för att studera biologiska strukturer och processer på nanoskala.
"Vi ser saker du inte kan se med befintlig teknik," sa Lew.
Mer information: Weiyan Zhou et al, Resolving the Nanoscale Structure of β-Sheet Peptide Self-Assemblys Using Single-Molecule Orientation–Localization Microscopy, ACS Nano (2024). DOI:10.1021/acsnano.3c11771
Journalinformation: ACS Nano
Tillhandahålls av Washington University i St. Louis