Forskare från Northwestern University har utvecklat den första selektiva behandlingen för att förhindra allergiska reaktioner, som kan variera i svårighetsgrad från kliande nässelutslag och rinnande ögon till andningssvårigheter och till och med dödsfall.
För att utveckla den nya terapin dekorerade forskare nanopartiklar med antikroppar som kan stänga av specifika immunceller (kallade mastceller) som är ansvariga för allergiska reaktioner. Nanopartikeln bär också på ett allergen som motsvarar patientens specifika allergi. Om en person är allergisk mot till exempel jordnötter, bär nanopartikeln ett jordnötsprotein.
I denna tvåstegsmetod engagerar allergenet de exakta mastcellerna som är ansvariga för den specifika allergin, och sedan stänger antikropparna endast dessa celler. Detta mycket riktade tillvägagångssätt gör det möjligt för terapin att selektivt förebygga specifika allergier utan att undertrycka hela immunsystemet.
I en musstudie visade terapin 100 % framgång för att förhindra allergiska reaktioner utan att orsaka märkbara biverkningar.
Forskningen publiceras idag (16 januari) i tidskriften Nature Nanotechnology . Det markerar den första nanoterapin för att hämma mastceller och på så sätt förhindra ett allergiskt svar på ett specifikt allergen.
"För närvarande finns det inga metoder tillgängliga för att specifikt rikta in sig på mastceller", säger Northwesterns Evan A. Scott, som ledde studien. "Allt vi har är mediciner som antihistaminer för att behandla symtom, och de förhindrar inte allergier. De motverkar effekterna av histaminer efter att mastcellerna redan har aktiverats.
"Om vi hade ett sätt att inaktivera mastcellerna som svarar på specifika allergener, skulle vi kunna stoppa farliga immunsvar i svåra situationer som anafylaxi såväl som mindre allvarliga reaktioner som säsongsbetonade allergier."
"Det största ouppfyllda behovet är anafylaxi, som kan vara livshotande", säger Northwesterns Dr. Bruce Bochner, allergiexpert och medförfattare till studien. "Vissa former av oral immunterapi kan vara till hjälp i vissa fall, men vi har för närvarande inga FDA-godkända behandlingsalternativ som konsekvent förhindrar sådana reaktioner förutom att undvika den kränkande maten eller medlet. Annars ges behandlingar som epinefrin för att behandla svåra reaktioner – inte förhindra dem.
"Skulle det inte vara bra om det fanns en säker och effektiv behandling för födoämnesallergi som konsekvent gjorde det möjligt att återinföra ett livsmedel i kosten som du förr var tvungen att absolut undvika?"
Scott är Kay Davis professor i biomedicinsk teknik vid Northwesterns McCormick School of Engineering och medlem av Simpson Querrey Institute for BioNanotechnology och International Institute for Nanotechnology. Bochner är Samuel M. Feinbergs emeritusprofessor i medicin (allergi och immunologi) vid Northwestern University Feinberg School of Medicine.
Tidningens första författare är Fanfan Du, en postdoktor vid Scotts laboratorium, som arbetade nära med förstaförfattarna Clayton Rische, en Ph.D. kandidat med mentor av både Bochner och Scott, och Yang Li, en Ph.D. kandidat i Scott-labbet.
Mastceller ligger i nästan alla vävnader i hela människokroppen och är mest kända för att vara primärt ansvariga för allergiska reaktioner. Men de spelar också flera andra viktiga roller, inklusive reglering av blodflödet och bekämpning av parasiter. Att helt eliminera mastceller för att förhindra allergiska reaktioner kan därför vara skadligt för andra användbara, hälsosamma reaktioner.
"Även om vissa läkemedel är under utveckling, finns det för närvarande inga FDA-godkända läkemedel som hämmar eller eliminerar mastceller", sa Bochner. "Detta har varit svårt främst eftersom läkemedel som kan påverka mastcellsaktivering eller överlevnad också riktar sig mot andra celler än mastceller, och därför tenderar att ha oönskade biverkningar på grund av påverkan på andra celler."
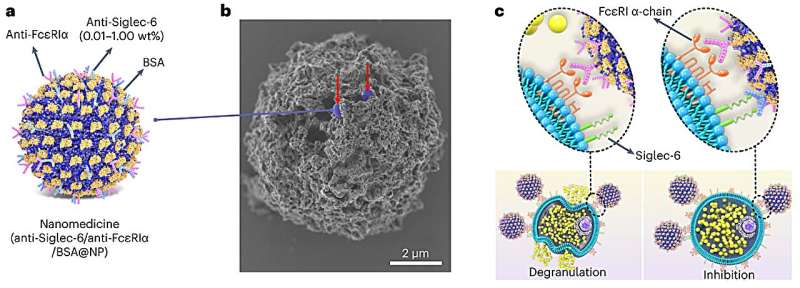
I tidigare arbete har Bochner identifierat Siglec-6, en unik hämmande receptor som finns mycket och selektivt på mastceller. Om forskare kunde rikta in sig på den receptorn med en antikropp, skulle de selektivt kunna hämma mastceller för att förhindra allergi. Men att introducera denna antikropp i sig självt misslyckades.
"Det var svårt att få en tillräckligt hög koncentration av antikroppen för att ha effekt", sa Scott. "Vi undrade om vi kunde öka denna koncentration med hjälp av en nanopartikel. Om vi kunde packa en hög täthet av antikroppar på en nanopartikel, då skulle vi kunna göra det praktiskt att använda."
För att packa antikropparna på en nanopartikel var Scott och hans team tvungna att övervinna en annan utmaning. För att proteiner (som antikroppar) ska hålla fast vid en nanopartikel måste de vanligtvis bilda en kemisk bindning som viker ut (eller denaturerar) proteinet, vilket påverkar dess biologiska aktivitet. För att kringgå denna utmaning vände sig Scott till en nanopartikel som tidigare utvecklats i hans laboratorium.
Till skillnad från mer vanliga nanopartiklar som har stabila ytor, består Scotts nyutvecklade nanopartikel av dynamiska polymerkedjor, som oberoende kan vända sin orientering vid exponering för olika lösningsmedel och proteiner. När de läggs i flytande lösningar, orienterar kedjorna sig själva för att uppnå gynnsamma elektrostatiska interaktioner med vattenmolekyler.
Men när ett protein vidrör nanopartikelns yta, vänder de specifika små polymerkedjorna vid gränssnittet sina orienteringar för att stabilt hålla fast vid proteinet utan att kovalent binda till det. Scotts team fann också att vattenavvisande fickor på proteinytor var nyckeln till den stabila interaktionen.
När proteiner binds till ytor denaturerar de vanligtvis och förlorar sin bioaktivitet. En unik aspekt av Scotts nanopartiklar är att de stabilt kan binda enzymer och antikroppar samtidigt som de bibehåller sin 3D-struktur och biologiska funktioner. Detta innebär att anti-Siglec-6-antikropparna bibehöll sin starka affinitet för mastcellsreceptorerna – även när de fästes på nanopartikelytorna.
"Detta är en unik dynamisk yta," sa Scott. "Istället för en vanlig stabil yta kan den byta ytkemi. Den är gjord av små polymerkedjor av föreningar, som kan vända deras orientering för att maximera gynnsamma interaktioner med både vatten och proteiner vid behov."
När Scotts team blandade nanopartiklarna med antikroppar, fäste nästan 100 % av antikropparna framgångsrikt till nanopartiklarna utan att förlora sin förmåga att binda till sina specifika mål. Detta resulterade i en nanopartikelbaserad terapi som använder ytor med tätt packade och mycket kontrollerbara mängder av flera distinkta antikroppar mot målmastceller.
För att någon ska bli allergisk, fångar deras mastceller in och visar antikroppar, specifikt immunglobulin E (IgE) antikroppar, för det specifika allergenet. Detta gör det möjligt för mastcellerna att känna igen – och reagera på – samma allergen vid återexponering.
"Om du har en jordnötsallergi och har haft ett svar på jordnötter tidigare, då gjorde dina immunceller IgE-antikroppar mot jordnötsproteiner, och mastcellerna samlade in dem," sa Scott. "Nu väntar de på att du ska äta en jordnöt till. När du gör det kan de svara inom några minuter, och om svaret är tillräckligt starkt kan det resultera i anafylaxi."
För att selektivt rikta in sig på mastceller för att svara på ett visst allergen, utformade forskarna sin terapi för att endast engagera mastceller som bär IgE-antikroppar för det allergenet. Nanopartikeln använder ett proteinallergen för att engagera sig med IgE-antikroppar på mastcellerna och använder sedan en antikropp för att koppla in Siglec-6-receptorn för att stänga av mastcellens förmåga att reagera. Och eftersom endast mastceller visar Siglec-6-receptorer kan nanopartikeln inte binda till andra celltyper – en strategi som effektivt begränsar biverkningar.
"Du kan använda vilket allergen du vill, och du kommer selektivt att stänga av svaret på det allergenet," sa Scott. "Allergenet skulle normalt aktivera mastcellen. Men samtidigt binder allergenet, antikroppen på nanopartikeln engagerar också den hämmande Siglec-6-receptorn. Givet dessa två motstridiga signaler bestämmer mastcellen att den inte ska aktiveras och bör lämna det allergenet ifred Det stoppar selektivt ett svar på ett specifikt allergen. Det fina med detta tillvägagångssätt är att det inte kräver att man dödar eller eliminerar alla mastceller celltyp, den cellen svarar helt enkelt inte."
Efter att ha visat framgång i cellulära kulturer med mänskliga vävnadshärledda mastceller, flyttade forskarna sin terapi till en humaniserad musmodell. Eftersom mastceller i möss inte har Siglec-6-receptorn, utvecklade Bochners team en musmodell med mänskliga mastceller i sina vävnader. Forskarna exponerade mössen för ett allergen och gav nanoterapin samtidigt.
Inga möss upplevde anafylaktisk chock och alla överlevde.
"Det enklaste sättet att övervaka ett allergiskt svar är att spåra förändringar i kroppstemperatur," sa Scott. "Vi såg inga temperaturförändringar. Det fanns inget svar. Dessutom förblev mössen friska och visade inga yttre tecken på en allergisk reaktion."
"Musmastceller har inte Siglec-6 på sin yta som hos människor, men vi kom så nära vi kunde för nu faktiska mänskliga studier genom att testa dessa nanopartiklar i speciella möss som hade mänskliga mastceller i sina vävnader," sa Bochner . "Vi kunde visa att dessa humaniserade möss var skyddade från anafylaxi."
Därefter planerar forskarna att utforska sin nanoterapi för att behandla andra mastcellsrelaterade sjukdomar, inklusive mastocytos, en sällsynt form av mastcellscancer. De undersöker också metoder för att ladda läkemedel inuti nanopartiklarna för att selektivt döda mastceller i mastocytos utan att skada andra celltyper.
Mer information: Fanfan Du et al, Kontrollerad adsorption av flera bioaktiva proteiner möjliggör målinriktad mastcells nanoterapi, Nature Nanotechnology (2024). DOI:10.1038/s41565-023-01584-z
Journalinformation: Nanoteknik
Tillhandahålls av Northwestern University