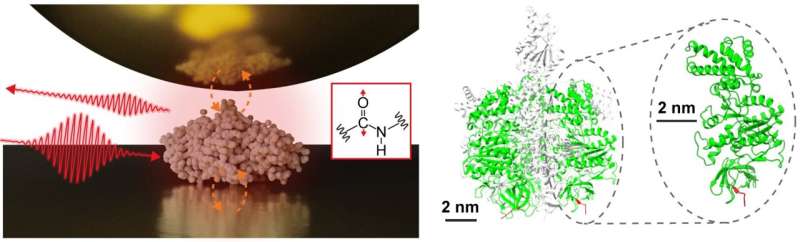
En tvärvetenskaplig forskargrupp, ledd av biträdande professor Jun Nishida och biträdande professor Takashi Kumagai vid Institutet för molekylär vetenskap, har framgångsrikt observerat vibrationsspektra av enskilda proteiner, bestående av cirka 500 aminosyrarester, med hjälp av avancerade mättekniker baserade på nära- optisk fältmikroskopi. Denna metod använder ljus som är begränsat på nanometerskala, vilket möjliggör detaljerad analys av extremt små prover, vilket tidigare var utmanande med konventionell infraröd spektroskopi.
Studien publiceras i tidskriften Nano Letters .
Konventionell infraröd spektroskopi har använts i stor utsträckning för strukturell och kemisk analys av olika material eftersom den kan mäta vibrationsspektra, ofta kallade "molekylära fingeravtryck."
Den nya bedriften representerar ett stort framsteg mot tekniska innovationer som ultrakänslig och superupplöst infraröd avbildning, såväl som vibrationsspektroskopi med en molekyl.
Den snabba utvecklingen av nanoteknik de senaste åren har lett till en ökande efterfrågan på ultrahög känslighet och superupplöst infraröd avbildning. Konventionell infraröd spektroskopi är dock begränsad när det gäller att mäta extremt små prover eller uppnå rumslig upplösning i nanometerskala. Till exempel kräver även infraröd mikrospektroskopi med god känslighet över en miljon proteiner för att erhålla ett infrarött spektrum, vilket gör det omöjligt att mäta bara ett enda protein.
I sin studie isolerade forskargruppen ett enda protein, en underenhet som består av ett proteinkomplex som kallas F1 -ATPas, på ett guldsubstrat och utförde närfältsmätningar av infraröd spektroskopi i en omgivande miljö.
De förvärvade framgångsrikt det infraröda vibrationsspektrumet för ett enda protein, vilket representerar ett stort framsteg som kan leda till att karakterisera lokala strukturella organisationer av enskilda proteiner. Sådan information är särskilt viktig för att förstå de sofistikerade funktionerna hos proteinkomplex och membranproteiner, vilket ger djupare insikter om deras mekanismer och interaktioner.
Dessutom har de utvecklat ett nytt teoretiskt ramverk som beskriver interaktionerna i nanoskala mellan det infraröda närområdet och proteinet.
Baserat på teorin kunde teamet kvantitativt reproducera de experimentella vibrationsspektra som de observerade. Dessa resultat kommer att vara ovärderliga för kemisk analys av biomolekyler såväl som olika nanomaterial, vilket banar väg för en rad tillämpningar av infraröd spektroskopi i nanoskala.
Mer information: Jun Nishida et al, Sub-Tip-Radius Near-Field Interactions in Nano-FTIR Vibrational Spectroscopy on Single Proteins, Nano Letters (2024). DOI:10.1021/acs.nanolett.3c03479
Journalinformation: Nanobokstäver
Tillhandahålls av National Institutes of Natural Sciences