Patienter som kämpar med vissa kroniska sjukdomar måste ofta vänta i flera år på att få en korrekt diagnos. Till exempel kan symtom som andnöd tillskrivas många lung- och hjärt-kärlsjukdomar, så patienter kan behandlas för en feldiagnostiserad sjukdom som är långt ifrån korrekt diagnos och behandling.
Därför är en av de mest lovande metoderna för att hantera detta problem att spåra nivåerna av specifika föreningar i kroppen under utvecklingen av en specifik sjukdom. I denna riktning presenterade forskare vid Institutet för fysikalisk kemi vid den polska vetenskapsakademin (Warszawa, Polen) och National Kaohsiung University i Kaohsiung (Kaohsiung, Taiwan) sin forskning om att utveckla en metod för snabb och effektiv diagnos av en dödlig lungsjukdom.
Idiopatisk lungfibros (IPF) är en kronisk sjukdom som orsakar lungfibros med dödlig utgång, vilket leder till kvävning. Dess vanligaste symtom är torr hosta och andnöd, som kan associeras med flera sjukdomar. Så det kan ofta feldiagnostiseras som många olika sjukdomar, vilket gör korrekt diagnos lång och mödosam, vilket dramatiskt påverkar en patients livskvalitet.
Dessutom kan symtomen fördröjas tills det är för sent att behandla patienten framgångsrikt. IPF-utveckling är fortfarande ett medicinskt mysterium. Därför finns det ett enormt behov av tidig diagnos av IPF. Elektrokemisk detektion av IPF-biomarkörer är en av lösningarna. Biomarkörer är specifika föreningar, t.ex. proteiner, nukleinsyror eller andra föreningar som onormalt produceras av kroppen under sjukdomsutveckling. För IPF kan flera biomarkörer urskiljas.
En av dem är matrix metalloproteinas-1 (MMP-1), som bryter ned fibrillära kollagener i luftvägarna. Trots de välkända kemiska egenskaperna hos MMP-1 är snabb övervakning av denna biomarkör i kroppsvätskor som en del av IPF-progression nu långt ifrån en drömdiagnos.
Nyligen riktade forskare från Institutet för fysikalisk kemi vid den polska vetenskapsakademin (IPC PAS) i Warszawa (Polen), i samarbete med forskare från Institutionen för kemi- och materialteknik vid National Kaohsiung University i Kaohsiung (Taiwan), snabb- spåra IPF och snabb diagnostik genom att ta fram en ny elektrokemisk kemosensor för selektiv, snabb och effektiv bestämning av IPF-biomarkören, särskilt MMP-1.
För att förbereda denna kemosensor förlitade sig forskarna på molekylär prägling i polymerer, en teknik baserad på att blanda en funktionell monomer, ett tvärbindningsmedel och en mall, följt av att generera en polymermatris som bildar (mallmolekyl)-formade molekylära hålrum som matchar en molekylär nyckel som passar in i polymerlåset.
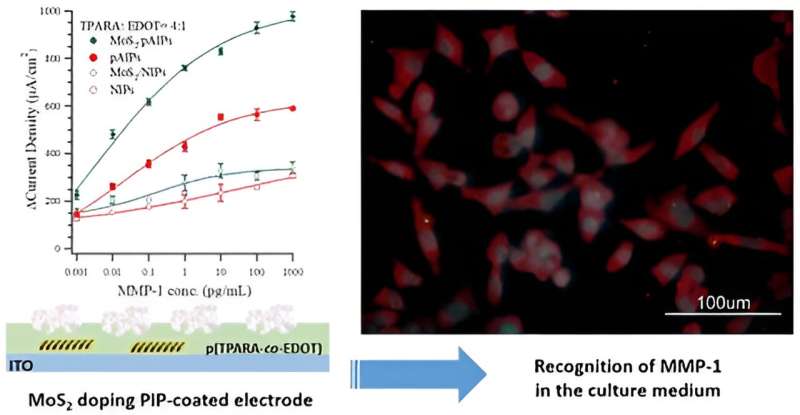
Specifikt modifierade de den genomskinliga elektroden (en glasskiva belagd med den ledande indium-tennoxiden kallad ITO) med en molekylärt präglad polymer (MIP), poly(TPARA-co-EDOT), gjord av två monomerer, EDOT och TPARA. Dessutom dopad med en MoS2 -2D-flakigt material, MIP var mall med peptidepitopen av MMP-1-proteinbiomarkören.
Därefter avlägsnades denna mall från MIP, vilket lämnade molekylära håligheter med en form och storlek som är karakteristisk för peptidepitopmolekylerna som används för prägling. Eftersom hålrummen matchar dessa karakteristiska peptidmolekyler, kan MIP enkelt användas för att bestämma den matchande molekylen. Intressant nog att dopa MIP med MoS2 ökade MMP-1-detektionsgränsen avsevärt jämfört med den odopade MIP.
Dr. Piyush S. Sharma hävdar:"Att införliva nya material i elektrokemiska kemosensorer kan förbättra deras prestanda och hjälpa till att klargöra deras avkänningsmekanism. I vår forskning dopades (peptidepitop)-mall MIP med MoS2 flingor med en medelstorlek på 0,6−1,5 μm under dess avsättning som en tunn film på en ITO-elektrod. I huvudsak fördubblade denna dopning det elektrokemiska svaret (ovanför bakgrunden) på MMP-1-proteinets målbiomarkör."
MMP-1-makromolekylen har flera peptider placerade vid sina kanter, de så kallade epitoperna, som känns igen av immunsystemet. Dessa epitoper kan framgångsrikt användas som ett avtryck i elektrokemiska MIP-kemosensorer. Eftersom proteinprägling inte skulle resultera i deras framgångsrika bestämning, vilket leder till stora håligheter som passar många mindre molekylföreningar, var de präglade molekylerna av peptidepitop, mycket mindre än proteiner.
Dessutom, förutom sin mindre storlek, är peptider mer stabila än proteiner under experimentella förhållanden, inklusive användning av ett organiskt lösningsmedel när man bildar en polymerfilm på elektrodytan. Det är värt att nämna att använda MoS2 flingor möjliggör detektering av MMP-1-biomarkören och därmed idiopatisk lungfibros.
"MoS2 -dopade pAIPs filmbelagda elektrodprestanda är jämförbar med den senaste litteraturen. Slutligen användes elektroden för att bestämma MMP-1 i odlingsmediet för genredigerade HEK293T-celler, och jämfört med en kommersiell ELISA-analys var dess noggrannhet hög", säger prof. Włodzimierz Kutner.
Denna forskning, detaljerad i ACS Applied Nano Materials , har ett löfte om att övervaka utvecklingen av kroniska och progressiva sjukdomar av okänd etiologi och patogenes, inklusive idiopatisk lungfibros.
Det finns fortfarande utrymme för att testa upptäckt under störande förhållanden, men förhoppningsvis kommer molekylär prägling i polymerer att få mer uppmärksamhet och tillämpning inom biomedicin, vilket för samhället närmare snabb och korrekt diagnos av många utmanande sjukdomar. Forskarna hoppas att deras beprövade koncept med en molekylärt präglad elektrokemisk kemosensor också kan anpassas till andra sjukdomar och personlig medicin.
Mer information: Mei-Hwa Lee et al, MoS2 Nanoark-dopade peptidpräglade polymerbelagda elektroder för elektrokemisk bestämning av CRISPR/dCas9-aktiverat proteinuttryck, ACS applicerade nanomaterial (2023). DOI:10.1021/acsanm.3c04130
Tillhandahålls av polska vetenskapsakademin