
Blodplättstransfusioner är avgörande för att hantera blödningar och hemostatisk dysfunktion, och kan utökas för att användas som cellterapi för en mängd olika sjukdomar. Ansträngningarna att skapa sådana cellterapier kräver att forskare modifierar donatorblodplättar för att uttrycka terapeutiska proteiner. Men för närvarande är lämpliga metoder för att genetiskt modifiera blodplättar som samlats in från blodgivare fortfarande svårfångade.
I en ny studie publicerad i Science Advances , Jerry Leung och ett team av forskare inom nanomedicin, biokemi och molekylärbiologi vid University of British Columbia, Kanada, Hokkaido University, Japan och olika institutioner i USA beskrev ett tillvägagångssätt baserat på trombocytoptimerade lipidnanopartiklar som innehåller mRNA för exogent proteinuttryck i blodplättar från människor och råttor.
När teamet testade biblioteket av mRNA-lipidnanopartiklar, korrelerade inte det resulterande exogena proteinuttrycket med trombocytaktivering. De transfekterade blodplättarna bibehöll hemostatisk funktion och ackumulerades i områden med kärlskada efter transfusion till råttor med förmågan att utöka den terapeutiska potentialen hos trombocyterna.
Blodplättar är en integrerad del av hemostas och transfunderas rutinmässigt för att återställa hemostatisk balans hos patienter. Dessa blodplättar kan utökas bortom indikationer som cellterapier för att behandla sepsis, inflammation och artrit. Genetiskt modifierade blodplättar kan skapa nya cellterapier som uttrycker terapeutiska proteiner, som kan implementeras för att modifiera donatorblodplättar. Befintliga metoder för elektroporering, virala vektorer och kommersiell transfektion har inte kunnat redigera donatorblodplättar och uttrycka exogena proteiner.
Indirekta tillvägagångssätt kan uttrycka exogena proteiner i blodplättar eller trombocytliknande partiklar genom att rikta in sig på stamceller från trombocytprekursorer med lentivirala vektorer. De donatorhärledda blodplättarna måste modifieras funktionellt för att skapa autentiska blodplättscellterapier.
Tidigare försök att transfektera trombocyter med lipidnanopartiklar som innehåller mRNA har visat möjligheten att mRNA levereras till blodplättarna, medan framsteg inom lipidnanopartikelteknologi har förbättrat dess potential att nå en bredare demografi.
I detta arbete rapporterade Leung och kollegor mRNA-lipidnanopartiklar för deras förmåga att direkt transfektera donatorblodplättar för att uttrycka exogena proteiner. Sådana blodplättar kan modifieras med mRNA-lipidnanopartiklar för att bibehålla sin funktion och ackumuleras lokalt i sår och reglera homeostas efter transfusion hos koagulopatiska råttor.
För att identifiera de effektiva transfektionsmetoderna för blodplättar levererade teamet mRNA som kodade för ett enzym NanoLuc luciferas (NanoLuc) med hjälp av flera transfektionsmedel och mätte deras uttryck. Medan NanoLuc var oupptäckt i blodplättar som behandlats med fritt mRNA utan ett transfektionsmedel eller genom att använda kommersiella mRNA-tillförselmedel, tillät processen upptag av stora mängder mRNA i blodplättarna.
Leung och team upptäckte NanoLuc-uttryck genom att använda en mRNA-lipidnanopartikelformulering som liknade den lilla störande RNA-lipidnanopartikeln som kliniskt bevisats behandla ärftlig amyloidos. Teamet jämförde mängden trombocytaktivering efter transfektion av mRNA-lipidnanopartiklar med obehandlade blodplättar.
För att identifiera den mRNA-lipid nanopartikelformulering som är mest lämpad för att transportera blodplättar, optimerade de tre huvudkomponenter; joniserbara lipider, länklipider och polyetylenglykollipiden. De screenade 10 joniserbara och två permanent katjoniska lipider och mätte deras proteinuttryck, mRNA-upptag och aktivering för att stödja proteinsyntesen.
Handlingar av de funktionaliserade lipidnanopartiklarna i labbet
För att undersöka hur kombinationen av joniserbara och hjälparlipider har synergistiska effekter för att förbättra proteinuttrycket samtidigt som blodplättsaktiveringen minimeras, studerade teamet två FDA-godkända joniserbara lipider. Bortsett från deras lipidsammansättning, spelade mRNA-elementen en betydande roll för att främja effektiv exogen proteinsyntes. Lipidnanopartiklarna som innehåller hjälplipider med fosfokolinhuvud, tillsammans med lipider med grenade eller omättade svansgrupper, var mest lämpade för blodplättstransfektion och för att driva högre uttrycksnivåer.
Av de RNA-modifieringar som testades i detta arbete noterade Leung och kollegor omodifierat uridin eller pseudouridin för att underlätta högre uttrycksnivåer av fluorescens. De observerade sedan om uttrycket av fluorescens berodde på graden av blodplättsaktivering, eller på mängden RNA som levererades, vilket de studerade med hjälp av en korrelationsmatrisanalys.
Även om fluorescensuttrycket inte starkt korrelerade med nivåer av blodplättar på ytan eller mRNA-upptag, noterade de en mild positiv korrelation mellan mängden levererat RNA och blodplättsaktivering. Eftersom NanoLuc-uttryck inte var starkt korrelerade med vare sig ytnivåer av trombocyter eller mRNA-upptag, testade teamet möjligheten att påverka dess uttryck genom att aktivera blodplättar med agonister före och efter transfektion av mRNA-lipidnanopartiklar.
Blodplättar stimulerade med adenosindifosfat, till exempel tvärbunden kollagenrelaterad peptid eller trombin före mRNA-lipidnanopartikelbehandlingen, hade signifikant mindre fluorescensuttryck. När Leung och teamet stimulerade blodplättar med agonister i mer än två timmar, genomgick de en betydande omarrangering av transkriptomet och proteomet. Resultaten visade att translationen av exogent mRNA inte krävde blodplättsaktivering.
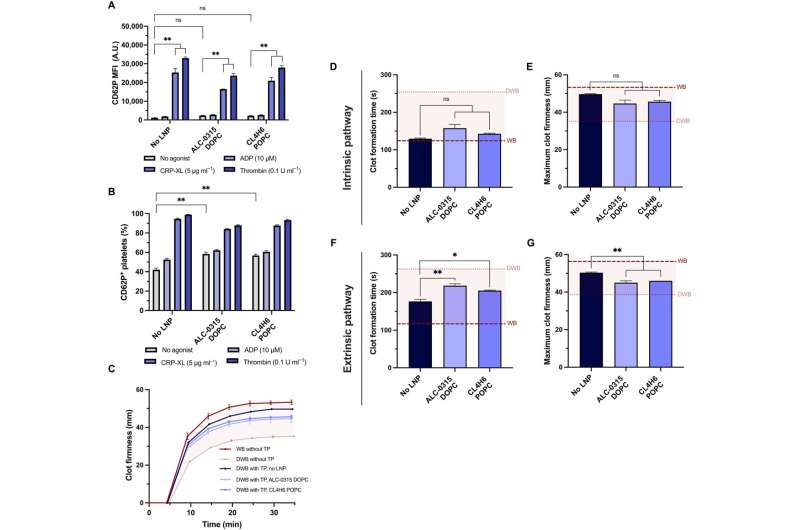
När teamet behandlade trombocyter med mRNA-lipidnanopartiklar bibehöll de hemostatisk funktion in vitro och visade hög känslighet för deras fysiska och kemiska miljöer. Teamet undersökte om blodplättarna fortfarande kunde aktiveras efter mRNA-lipid-nanopartikeltransfektion och mätte deras aktiveringstillstånd och svar på fysiologiska agonister.
Teamet testade kapaciteten hos transfekterade blodplättar att behålla sin potential att bidra till fastheten och hastigheten för koagelbildning med hjälp av en modell för rotationstromboelastometri och en ex vivo-modell för att testa blodplättsaktivitet i helblod. Forskarna modellerade utspädningskoagulopati med hjälp av utspätt helblod och beredda blodplättar i en transfusionsförpackning.
När de kombinerade transfusionspaketet med utspätt helblod för att modellera sjukdomen som den inträffar hos en patient, noterade de att lipidnanopartiklarna inte påverkade trombocytkoagulopati in vitro. Dessutom undersökte teamet uttrycket av blodplättar transfekterade med mRNA-lipidnanopartiklar uttryckta med NanoLuc, cirkulerade och lokaliserade till sårställen efter transfusion till koagulopatiska gnagare.
På detta sätt riktade Jerry Leung och kollegor leveransen av molekyler och cellterapier till kärlplatser av intresse genom att använda de naturligt kompetenta blodplättarna som i sig kan utföra denna uppgift. Teamet utvecklade trombocytoptimerade lipidnanopartiklar och mRNA för framgångsrikt proteinuttryck, samtidigt som trombocyternas cirkulära funktion och lokal ackumulering på kärlstället av intresse presenterades.
Det är möjligt att uppnå leverans av nukleinsyror och exogen translation med hjälp av trombocytoptimerade mRNA-lipidnanopartiklar för att bredda och konstruera blodplättar för en mängd olika kliniska tillämpningar. Sådana donatorblodplättar konstruerade med mRNA-lipidnanopartiklar kan behandla akuta blödningsrubbningar med bredare tillämpningar inom onkologi. Dessa blodplättar transfunderade med optimerade mRNA-lipidnanopartiklar är funktionellt transfuserbara och kan ackumuleras vid kärlstället för effektiva blodplättsterapier för att modulera hematologiska störningar.
Mer information: Jerry Leung et al, Genetiskt framställda transfuserbara blodplättar med hjälp av mRNA-lipidnanopartiklar, Science Advances (2023). DOI:10.1126/sciadv.adi0508
Journalinformation: Vetenskapens framsteg
© 2023 Science X Network