
Förmågan att reglera biodistributionen av läkemedel är en mycket önskad egenskap som kan begränsa biverkningarna av många läkemedel. I en ny studie i Scientific Reports , Noah Joseph, och ett team av bioteknik- och nanovetenskapsforskare i Israel, beskriver ett medel i nanoskala som utvecklats från en kopplad polymer-DNA-origamihybrid som kan uppvisa stabilitet i serum och långsam diffusion genom vävnader.
Genom att koppla till fragment av polyetylenglykol genom elektrostatiska polyamininteraktioner noterade teamet markant stabilitet hos medlen in vivo, där mer än 90 % av beståndsdelarna bibehöll strukturell integritet i fem dagar efter subkutan injektion.
Resultaten framhäver polymer-DNA-hybridnanostrukturerna som livskraftiga farmakologiska medel som kan komma in i vanliga teknologier, inklusive deras användning som monoklonala antikroppar för läkemedelsaktivitet.
Många läkemedel, inklusive små molekyler och biologiska, fungerar systematiskt utan den medfödda kapaciteten för distribution och funktion. Detta är den centrala drivkraften för biverkningar och en viktig del av läkemedelsnedsättningen för många nya läkemedel i kliniska prövningar och klinisk användning.
Även om stora ansträngningar har gjorts under de senaste decennierna för att uppnå reglering av läkemedelsaktivitet, representerar de godkända läkemedlen för närvarande bara en liten del av den verkliga potentialen hos läkemedels terapeutiska mekanismer.
Monoklonala antikroppar är en vanlig och väl beprövad farmaceutisk metod som exemplifierar denna utmaning. De monoklonala läkemedlen har möjliggjort banbrytande behandlingar av sjukdomar som hittills ansetts vara nästan obehandlade inom onkologi, immunologi och inflammatoriska sjukdomar. Scaffolded DNA origami är en metod för att utveckla DNA-nanostrukturer och underlätta den exakta rumsliga regleringen och funktionaliteten på sub-nm-skala.
De unika egenskaperna lämpar sig för en mängd olika forskningsområden, för att markera dem som nästa generations terapeutiska och diagnostiska medel. En mängd olika DNA-origamifunktionaliseringsmetoder kan uppnå högre funktionell komplexitet jämfört med monoklonala antikroppar.
I denna nya strategi presenterad av Joseph och kollegor, underlättade teamet den rumsliga regleringen av läkemedelsaktivitet genom att koppla polymer-DNA-origami-hybridmedel i nanoskala. Dessa konstruktioner kan anpassas över flera målproteiner för en mängd olika patologier med omfattande terapeutisk funktionalitet.
I detta arbete presenterade Joseph och kollegor en strategi för att leverera terapeutiska läkemedelskomponenter baserade på kopplade polymer-DNA-origamihybridföreningar i nanoskala. Genom att följa de vanliga, kinetiska och stabilitetskarakteriseringsstudier av flera DNA-origami-konstruktioner in vivo, valde forskarna en optimal DNA-nanostruktur som ett bevis på principen för terapeutiska tillämpningar med mycket potenta antiinflammatoriska effekter i en musmodell och i mänsklig tumör Nekrosfaktor alfa.
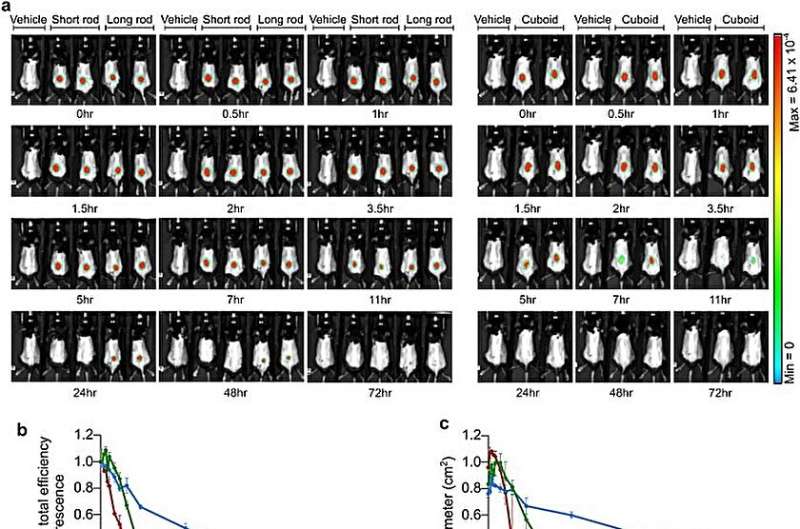
Experimenten
För att påbörja proof-of-feasibility-studien valde forskargruppen tre olika DNA-origami nanostrukturer med liknande massa och analyserade dem med gelelektrofores för att bestämma bulkkvaliteten. De använde transmissionselektronmikroskopi före och efter beläggning av DNA-nanostrukturerna med polyetylenglykosylat-polylysin genom amin- och fosfatinteraktioner för att öka massan av DNA och öka deras vidhäftning till polyetylenglykosylat och säkerställa stabiliteten hos DNA-origaminanostrukturerna.
Läkemedel med in vivo-stabilitet är lämpade för distribution och teamet utforskade detta genom att utföra levande avbildning av möss som behandlats med de polymerbelagda nanostrukturerna administrerade subkutant i knäleder eller intraperitonealt till möss.
Medan den långa staven visade förlängd diffusion över tiden, var det möjligt att kombinera långsammare diffusion med större stabilitet subkutant. Forskarna undersökte kinetiken och in vivo-stabiliteten hos fynden för att välja polymerräkningsstavarnanostrukturer som effektiva beståndsdelar för drogbara experiment.
Forskarna studerade de omgjorda långa nanostrukturerna för att representera den mänskliga tumörnekrosfaktorn alfa-aptamerer och förankrade dem enhetligt över ytstrukturerna. Joseph och kollegor analyserade funktionaliseringen av origamistrukturer i DNA med långa stavar genom att använda agarosgelelektrofores, transmissionselektronmikroskopi och atomkraftsmikroskopi.
Teamet undersökte stabiliteten hos beståndsdelarna i humant serum under 10 dagar och identifierade dess strukturella integritet för biodistribution och in vivo-studier.
På detta sätt beskriver Noah Joseph och forskargruppen in vivo-kinetiken för tre DNA-origaminanostrukturer av olika former stabiliserade av polyetylenglykol-polylysin-polymeren. Forskarna valde den optimala kandidaten och funktionaliserade de långa stavnanostrukturerna genom att fästa human tumörnekrosfaktor alfa-aptamerer för att rikta in sig på humant tumörnekrosfaktor alfaprotein.
Forskargruppen beskriver den terapeutiska potentialen hos de funktionaliserade sampolymer-DNA-origaminanostrukturerna för att fungera över komplexa biologiska miljöer. De kombinerade resultaten framhäver inverkan av DNA-nanostrukturerna som ett betydande terapeutiskt medel för precisionsmedicin och funktionalitet hos terapeutiska medel.
Mer information: Noah Joseph et al, Biodistribution and function of coupled polymer-DNA origami nanostructures, Scientific Reports (2023). DOI:10.1038/s41598-023-46351-1
Journalinformation: Vetenskapliga rapporter , Vetenskapens framsteg
© 2023 Science X Network