Ett team av forskare ledda av University of Oxford har uppnått ett betydande genombrott när det gäller att upptäcka modifieringar på proteinstrukturer. Metoden, publicerad i Nature Nanotechnology , använder innovativ nanopore-teknologi för att identifiera strukturella variationer på singelmolekylnivå, även djupt inne i långa proteinkedjor.
Mänskliga celler innehåller cirka 20 000 proteinkodande gener. Det faktiska antalet proteiner som observeras i celler är dock mycket större, med över 1 000 000 olika strukturer kända. Dessa varianter genereras genom en process som kallas posttranslationell modifiering (PTM), som sker efter att ett protein har transkriberats från DNA.
PTM introducerar strukturella förändringar såsom tillägg av kemiska grupper eller kolhydratkedjor till de individuella aminosyrorna som utgör proteiner. Detta resulterar i hundratals möjliga variationer för samma proteinkedja.
Dessa varianter spelar centrala roller inom biologin, genom att möjliggöra exakt reglering av komplexa biologiska processer inom enskilda celler. Att kartlägga denna variation skulle avslöja en mängd värdefull information som skulle kunna revolutionera vår förståelse av cellulära funktioner. Men hittills har förmågan att producera omfattande proteininventeringar förblivit ett svårfångat mål.
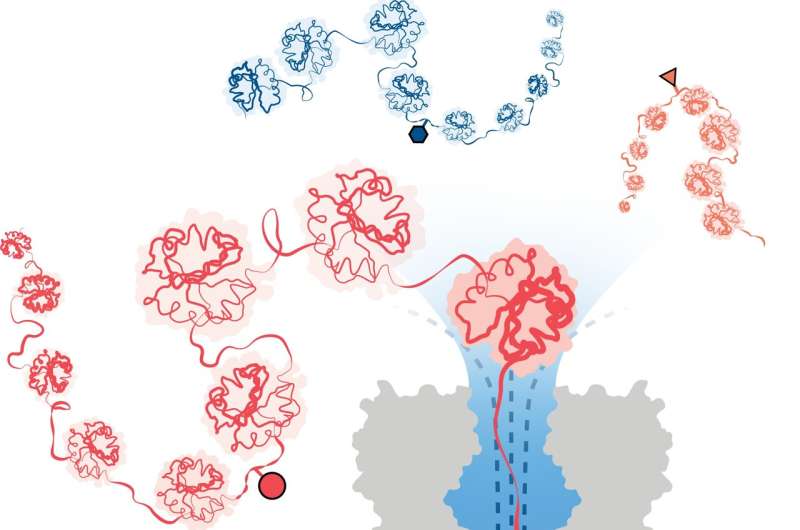
För att övervinna detta har ett team ledd av forskare vid University of Oxfords kemiavdelning framgångsrikt utvecklat en metod för proteinanalys baserad på nanopore DNA/RNA-sekvenseringsteknologi. I detta tillvägagångssätt fångar ett riktat flöde av vatten 3D-proteiner till linjära kedjor som matas genom små porer, precis tillräckligt breda för att en enda aminosyramolekyl ska kunna passera igenom.
Strukturella variationer identifieras genom att mäta förändringar i en elektrisk ström som appliceras över nanoporen. Olika molekyler orsakar olika störningar i strömmen, vilket ger dem en unik signatur.
Teamet demonstrerade framgångsrikt metodens effektivitet för att detektera tre olika PTM-modifieringar (fosforylering, glutationylering och glykosylering) på enkelmolekylnivå för proteinkedjor över 1 200 rester långa. Dessa inkluderade modifieringar djupt inne i proteinets sekvens. Viktigt är att metoden inte kräver användning av etiketter, enzymer eller ytterligare reagens.
Enligt forskargruppen kan den nya proteinkarakteriseringsmetoden enkelt integreras i befintliga bärbara nanopore-sekvenseringsenheter för att göra det möjligt för forskare att snabbt bygga proteinlager av enskilda celler och vävnader. Detta skulle kunna underlätta diagnostik på vårdställen, vilket möjliggör personlig detektering av specifika proteinvarianter associerade med sjukdomar inklusive cancer och neurodegenerativa sjukdomar.
Professor Yujia Qing (Department of Chemistry, University of Oxford), bidragande författare till studien, sa:"Denna enkla men kraftfulla metod öppnar upp för många möjligheter. Inledningsvis möjliggör den undersökning av individuella proteiner, till exempel de som är involverade i specifika sjukdomar. På längre sikt har metoden potential att skapa utökade lager av proteinvarianter inom celler, vilket låser upp djupare insikter i cellulära processer och sjukdomsmekanismer."
Professor Hagan Bayley (Department of Chemistry, University of Oxford), bidragande författare och medgrundare av Oxford Nanopore Technologies, tillade:"Förmågan att lokalisera och identifiera post-translationella modifieringar och andra proteinvariationer på singelmolekylnivå lovar oerhört mycket. för att främja vår förståelse av cellulära funktioner och molekylära interaktioner Det kan också öppna nya vägar för personlig medicin, diagnostik och terapeutiska interventioner."
Detta arbete utfördes i samarbete med mekanobiologen Sergi Garcia-Maynes forskargrupp vid King's College London och Francis Crick Institute.
Mer information: Pablo Martin-Baniandres et al, Enzymfri nanopordetektion av posttranslationella modifieringar inom långa polypeptider, Nature Nanotechnology (2023). DOI:10.1038/s41565-023-01462-8
Journalinformation: Nanoteknik i naturen
Tillhandahålls av University of Oxford