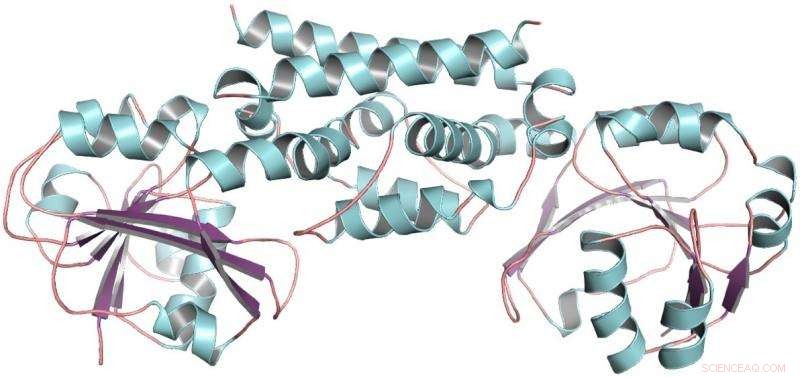
Den tredimensionella strukturen av PDH-enzymet från sojabönor, en baljväxt. Denna struktur hjälpte till att visa att endast en mutation tillät baljväxter att utveckla ett nytt sätt att göra aminosyran tyrosin. Kredit:Craig Schenck
När du biter i din nästa smörgås med jordnötssmör och gelé, tugga på detta:Jordnöten du äter har en hemlighet.
Det är en subtil sådan. Jordnöten och dess släktingar — baljväxter — har ingen, men två sätt att göra aminosyran tyrosin, en av de 20 som krävs för att göra alla dess proteiner, och ett viktigt mänskligt näringsämne. Det kan tyckas litet, men varför denna växtfamilj har ett unikt sätt att göra en så viktig kemisk byggsten är ett mysterium som sträcker sig tillbaka till 1960-talet och som har fångat Hiroshi Maedas uppmärksamhet, professor i botanik vid University of Wisconsin–Madison.
"Vi är intresserade av växtkemi, försöker förstå hur växter gör så många olika kemiska föreningar, många av dem är viktiga för vårt mänskliga samhälle som mat, fiber, utfodra, bränsle, medicin - så många saker, säger Maeda.
Dessa viktiga molekyler utgår från enklare föreningar, som tyrosin, som är föregångaren till morfin och otaliga andra intressanta och användbara kemikalier.
I ny forskning publicerad i 26 juni numret av Naturens kemiska biologi , Maeda och hans doktorand Craig Schenck, tillsammans med medarbetare vid Washington University i St. Louis, rapportera hur baljväxtfamiljen utvecklade sin andra tyrosinväg. De upptäckte strukturen av ett nytt växtenzym, en som skulle kunna vara ett användbart verktyg för bioteknologer som försöker kontrollera produktionen av tyrosin och dess derivat. Och de kopplade en stor evolutionär förändring i växternas metabolism till en enda mutation i det nya enzymet.
På 1960- och 70-talen, forskare undersökte växtvärlden för att hitta hur de gjorde viktiga metaboliska föreningar, som aminosyror. Medan alla växter använde en väg, känd som ADH, att göra tyrosin, baljväxtfamiljen - ärtor, bönor, jordnötter – unikt lagt till en sekund, kallas PDH, som annars bara fanns i mikrober. Ingen visste varför, och problemet lades åt sidan.
Men för två år sedan Maeda och Schenck dammade av det gamla mysteriet. Gräver i, de upptäckte generna som är ansvariga för att göra tyrosin. De fann att baljväxterna hade utvecklat sina PDH-enzymer från befintliga ADH, precis innan jordnötter och ärter utvecklades till separata härstamningar. Systerenzymerna var väldigt lika, vilket innebar att endast ett litet antal förändringar kunde förklara hur ADH-enzymerna utvecklades till PDH. Men det var fortfarande för många förändringar för att testa en efter en för att se vilka som hade effekt.
Sedan fick Maeda ett samtal från Joe Jez, en biokemist vid Washington University. Med Jez elev Cynthia Holland, de två teamen samarbetade för att rena PDH-enzymet från sojabönor, en baljväxt, och bestämma dess tredimensionella struktur. Med strukturen av PDH i hand, Schenck kunde se det under evolutionär tid, endast ett par mutationer hade inträffat på platsen där de kemiska reaktionerna äger rum. Istället för dussintals mutationer att prova, han hade bara två.
Schenck fann att genom att ändra en enda aminosyra i mitten av enzymet, han kunde till stor del omvandla sojabönens PDH-enzymet tillbaka till dess förfader ADH-enzym. Switchen fungerade för enzymer från flera arter, och fungerade omvänt:Schenck kunde ge ADH-enzymer från icke-baljväxter PDH-liknande egenskaper.
Maeda och Schenck hade upptäckt att baljväxter utvecklade ett nytt sätt att tillverka en viktig kemikalie, främst genom att snubbla på en enda, avgörande switch.
"Det mest överraskande resultatet är att en enda rest verkligen spelade en stor roll vid bytet till detta baljväxtspecifika enzym, " säger Maeda. "Och det väcker en intressant fråga om varför andra grupper av växter aldrig utvecklade detta unika enzym. För bara med en slump, kanske inträffade denna mutation men upprätthölls aldrig."
Precis varför baljväxter höll fast vid sin nya tyrosinväg, och vilken fördel det kan ge, kommer att kräva mer arbete.
Ännu en takeaway, säger Maeda, är att samma omkopplare som gör ADH-enzymer till PDH-enzymer stänger av tyrosinets förmåga att hämma enzymets funktion. Även om denna typ av självreglering normalt är användbar för celler, Maeda tror att PDH-okänsligheten för tyrosin kan vara en välsignelse för att hjälpa till att producera mer tyrosin, och dess användbara derivat, i system som jäst eller tekniska växter.
"Tanken är att opiumvallmo, till exempel, tillverkar tyrosin genom en standard ADH-väg som sannolikt hämmas av tyrosin, " förklarar Schenck, som nyligen avslutade sin doktorsexamen i Maedas labb, diskutera möjliga tillämpningar för den nya forskningen. "Om vi kan introducera ett enzym som inte hämmas av tyrosin, kanske vi kan öka den totala poolen av prekursorn tyrosin för att öka morfinproduktionen. Det kan vara ett användbart verktyg framöver i andra växtarter eller till och med i mikrober."