
En handfull europium. Kredit:Alchemist-hp, CC BY-SA
De flesta amerikaner använder sällsynta jordartsmetaller varje dag – utan att veta om det, eller vet något om vad de gör. Det kan ändras, eftersom dessa ovanliga material håller på att bli en samlingspunkt i det eskalerande handelskriget mellan USA och Kina.
Stanley Mertzman, en geolog vars specialitet är röntgenanalys av bergarter och mineraler för att bestämma deras kemiska sammansättning, och som undervisar i mineralogi vid Franklin and Marshall College, förklarar mer om dessa föga kända och fascinerande element – och den moderna elektronik de möjliggör.
1. Vad är sällsynta jordartsmetaller?
Strängt talat, de är grundämnen som andra i det periodiska systemet – som kol, väte och syre – med atomnummer 57 till 71. Det finns två andra med liknande egenskaper som ibland är grupperade med dem, men de viktigaste sällsynta jordartsmetallerna är de 15. För att göra det första, lantan, börja med en bariumatom och lägg till en proton och en elektron. Varje på varandra följande sällsynt jordartsmetall lägger till en proton till och en till elektron.
Det är betydelsefullt att det finns 15 sällsynta jordartsmetaller:Kemistudenter kan komma ihåg att när elektroner läggs till en atom, de samlas i grupper eller lager, kallas orbitaler, som är som koncentriska cirklar av ett mål runt kärnans öga.
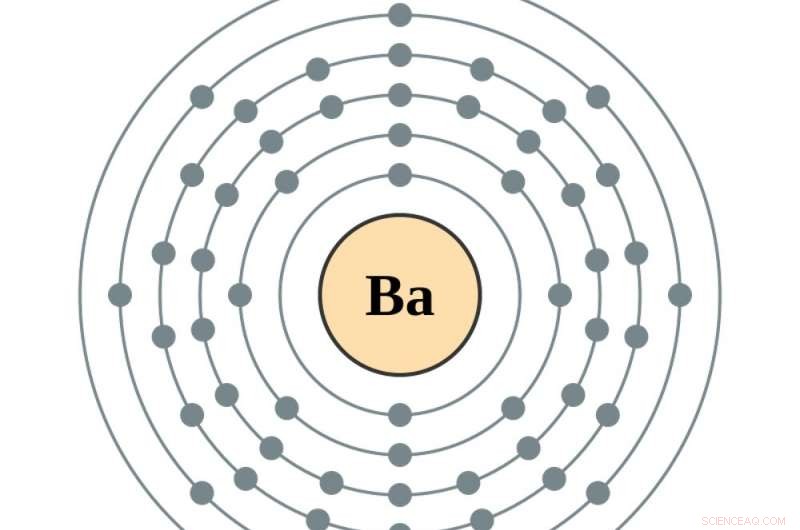
Ett elektrondiagram av ett bariumelement, det sista elementet före de sällsynta jordartsmetallerna lantanid. Kredit:Greg Robson och Pumbaa, CC BY-SA
Den innersta målcirkeln av en atom kan innehålla två elektroner; att lägga till en tredje elektron innebär att man lägger till en i den andra målcirkeln. Det är dit de nästa sju elektronerna går, också – varefter elektroner måste gå till den tredje målcirkeln, som kan hålla 18. Nästa 18 elektroner går in i den fjärde målcirkeln.
Sedan börjar det bli lite konstigt. Även om det fortfarande finns plats för elektroner i den fjärde målcirkeln, nästa åtta elektroner går in i den femte målcirkeln. Och trots mer utrymme i den femte, de nästa två elektronerna efter det går in i den sjätte målcirkeln.
Det är då atomen blir barium, atomnummer 56, och de tomma utrymmena i tidigare målcirklar börjar fyllas. Lägga till en elektron till - för att göra lantan, den första i serien av sällsynta jordartsmetaller – placerar den elektronen i den femte cirkeln. Lägger till en annan, att göra cerium, atomnummer 58, lägger till en elektron till den fjärde cirkeln. Att göra nästa element, praseodym, flyttar faktiskt den nyaste elektronen i den femte cirkeln till den fjärde, och lägger till en till. Därifrån, ytterligare elektroner fyller upp den fjärde cirkeln.
I alla delar, elektronerna i den yttersta cirkeln påverkar till stor del grundämnets kemiska egenskaper. Eftersom de sällsynta jordartsmetallerna har identiska yttersta elektronkonfigurationer, deras egenskaper är ganska lika.
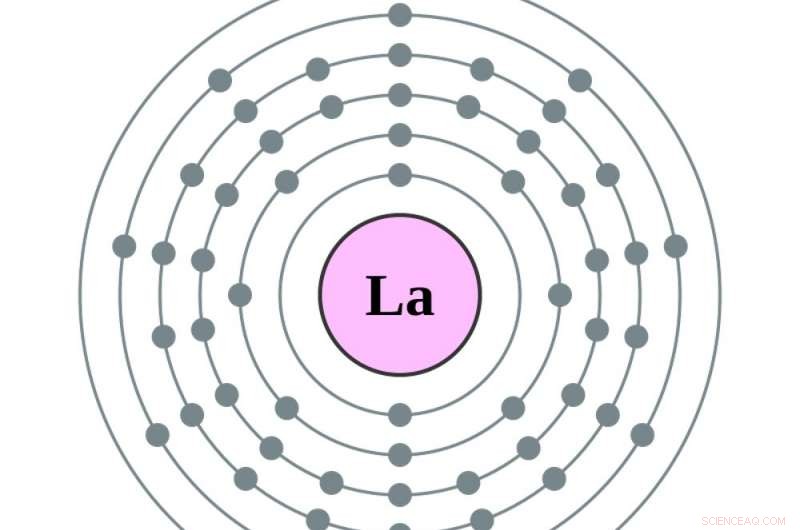
Ett elektrondiagram över en lantanatom, med en elektron mer i sin femte orbital än barium. Kredit:Greg Robson och Pumbaa, CC BY-SA
2. Är sällsynta jordartsmetaller verkligen sällsynta?
Nej. De är mycket rikligare i jordskorpan än många andra värdefulla element. Även den mest sällsynta jordarten, thulium, med atomnummer 69, är 125 gånger vanligare än guld. Och den minst sällsynta sällsynta jordarten, cerium, med atomnummer 58, är 15, 000 gånger rikligare än guld.
De är sällsynta i en mening, men - mineraloger skulle kalla dem "spridda, " vilket betyder att de mestadels strös över planeten i relativt låga koncentrationer. Sällsynta jordartsmetaller finns ofta i sällsynta magmatiska bergarter som kallas karbonatiter - inget så vanligt som basalt från Hawaii eller Island, eller andesit från Mount St. Helens eller Guatemalas vulkan Fuego.
Det finns några regioner som har massor av sällsynta jordartsmetaller – och de är mestadels i Kina, som producerar mer än 80 procent av den globala årliga totalen på 130, 000 ton. Australien har också några områden, liksom vissa andra länder. USA har ett litet område med massor av sällsynta jordartsmetaller, men den sista amerikanska källan för dem, Kaliforniens bergspassbrott, stängt 2015.
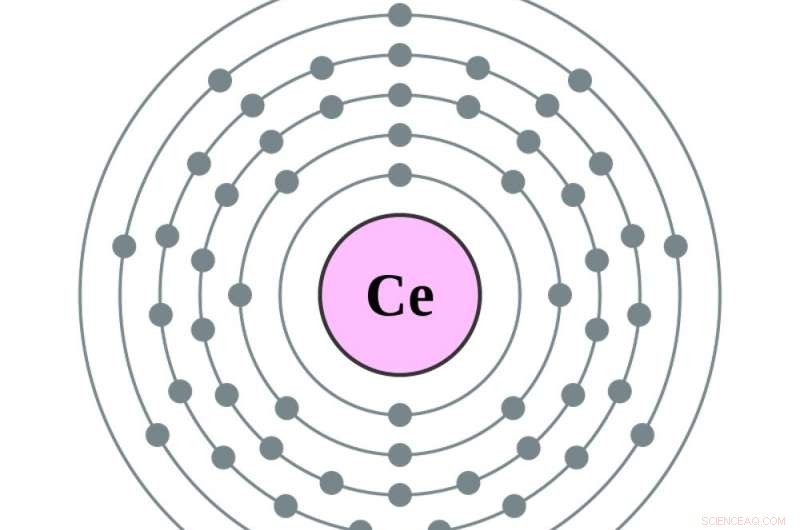
Cerium har en elektron mer i sin femte orbital och en mer i sin fjärde än barium. Kredit:Greg Robson och Pumbaa, CC BY-SA
3. Om de inte är sällsynta, är de väldigt dyra?
Ja, ganska. Under 2018, kostnaden för en oxid av neodym, atomnummer 60, är 107 USD, 000 per ton. Priset förväntas stiga till $150, 000 till 2025.
Europium är ännu dyrare – cirka 712 USD, 000 per ton.
En del av anledningen är att sällsynta jordartsmetaller kan vara kemiskt svåra att separera från varandra för att få ett rent ämne.

Det sällsynta sällsynta jordartselementet, thulium. Kredit:Jurii, CC BY
4. Vad är sällsynta jordartsmetaller användbara för?
Under sista hälften av 1900-talet, europium, med atomnummer 63, fick stor efterfrågan på sin roll som färgproducerande fosfor i videoskärmar, inklusive datorskärmar och plasma-TV. Det är också användbart för att absorbera neutroner i kärnreaktorernas kontrollstavar.
Andra sällsynta jordartsmetaller används också ofta i elektroniska enheter idag. Neodym, atomnummer 60, till exempel, är en kraftfull magnet, användbar i smartphones, tv-apparater, lasrar, uppladdningsbara batterier och hårddiskar. En kommande version av Teslas elbilsmotor förväntas också använda neodym.
Efterfrågan på sällsynta jordartsmetaller har ökat stadigt sedan mitten av 1900-talet, och det finns inga egentliga alternativa material att ersätta dem. Lika viktiga som sällsynta jordartsmetaller är för ett modernt teknikbaserat samhälle, och hur svåra de än är att bryta och använda, tullstriden kan sätta USA på en mycket dålig plats, att förvandla både landet och de sällsynta jordartselementen till bönder i detta parti ekonomiskt schack.

En kub av små neodymmagneter. Kredit:XRDoDRX, CC BY-SA
Denna artikel publicerades ursprungligen på The Conversation. Läs originalartikeln. 