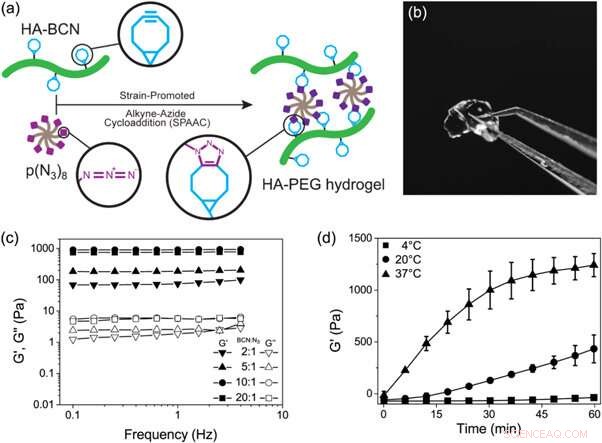
(a) Schematisk representation av bildningen av HA-PEG-hydrogeler genom en stambefrämjad alkyn-azidcykloadditionsreaktion. (b) Fotografi av en HA-PEG-hydrogel efter bildning. (c) Frekvenssvep av HA-PEG-hydrogeler med olika BCN till N3-förhållanden. (d) Gelningstidsexperiment som visar ökningen av G' över tiden under gelning av HA-PEG-hydrogeler (10:1 BCN:N3) vid olika temperaturer. Kreditera: Biotillverkning , doi:https://doi.org/10.1088/1758-5090/aaf657
Lever-på-ett-chip-cellodlingsenheter är attraktiva biomimetiska modeller för läkemedelsupptäckt, toxikologi och vävnadsteknisk forskning. För att upprätthålla specifika levercellsfunktioner på ett chip i labbet, lämpliga celltyper och odlingsvillkor måste uppfyllas, som inkluderar 3D-cellorientering och en konsekvent tillförsel av näringsämnen och syre. Jämfört med konventionella 2D-cellodlingstekniker, organ-on-a-chip-enheter erbjuder mångsidighet och effektiv biomimik lämpad för avancerade tillämpningar inom läkemedelsupptäckt och medicin.
I en nyligen publicerad studie nu publicerad på Biotillverkning , Jonas Christoffersson och kollegor visade hur hydrogeler som efterliknar den extracellulära matrisen kan stödja funktionaliteten och livskraften hos hepatocyter i en perfunderad lever-på-chip-enhet. De tvärvetenskapliga forskarna inom divisionen bioteknik och molekylär fysik konstruerade ett hydrogelsystem baserat på hyaluronan och poly(etylenglykol) (HA-PEG) polymerer. De utvecklade hydrogelerna med hjälp av klickkemi. För att aktivera processen, forskarna genomförde en biortogonal reaktion (kemi som sker i levande system utan inblandning av inhemska biokemiska reaktioner) mellan en cyklooktyndel och alkynazidmärkt reaktionspartner, känd som stambefrämjad alkynazidcykloaddition (SPAAC).
De nya hydrogelmaterialen konstruerades och karakteriserades i jämförelse med befintliga agaros- och alginathydrogeler för cellkompatibilitet (cytokompatibilitet). För biofunktionaliseringsstudier, forskarna använde mänskliga inducerade-pluripotenta stamcellshärledda hepatocyter (hiPS-HEPs). För att förbättra ytcytokompatibiliteten hos biomaterialet, HA-PEG-hydrogeler förändrades med azid-modifierade cellvidhäftningsmotiv för att underlätta effektiva cellmaterialfästningar. I det ytfunktionaliserade biomaterialet, hepatocytstamcellerna migrerade och växte i 3D-orientering, med ökad livskraft. Forskarna observerade högre albuminproduktion på det nya materialet (karakteristiskt leverprotein), jämfört med celler odlade på andra hydrogeler. Den flexibla, SPAAC tvärbundet hydrogelsystem med perfunderad 3D-cellkultur av hiPS-HEPs är ett lovande material för att optimera lever-på-ett-chip-enheter.
Miniatyriserade bioreaktorer kända som "organ-på-chips", har nyligen dykt upp som alternativa cellodlingsmodeller som bättre efterliknar den biologiska mikromiljön in vivo i labbet. Levern är en modell av speciellt intresse för medicinsk forskning på grund av läkemedelslevertoxicitet som observerats i alla faser av klinisk läkemedelsutveckling. Tidigare publikationer beskriver användningen av organ-on-chips för att förutsäga resultatet av ett läkemedels inverkan i kliniska prövningar och utvärdera läkemedelsinteraktioner med hepatocyter i labbet.
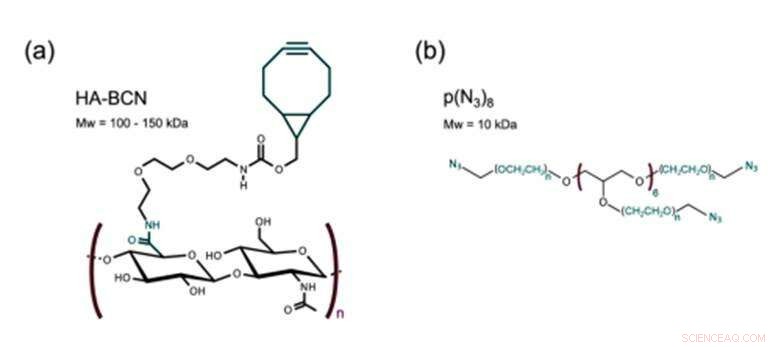
Struktur av a) HA-BCN med ett förhållande n/m på 0,19 och b) p(N3)8. Kreditera: Biotillverkning , doi:https://doi.org/10.1088/1758-5090/aaf657
På grund av deras bredare användning i akademiska och industriella miljöer, bioreaktorerna kräver optimerade material och förhållanden för tillverkning med hög genomströmning. Villkoren inkluderar att ersätta det vanliga prototypmaterialet polydimetylsiloxan (PDMS), integrera inducerade pluripotenta stamceller (iPSC)-härledda celler på ett mjukt biomaterial som underlättar deras tillväxt och minimerar den stora döda volymen som orsakas av mikrofluidikreservoarer och slangar av organ-on-chip-enheter.
Det nya biomaterialet som framställts i studien innehöll två huvudbeståndsdelar tvärbundna via SPAAC; en cykloocytmodifierad hyaluronan (HA-BCN) och en multiarmad azidmodifierad PEG [p(N 3 ) 8 ]. BCN reagerade med azider (N 3 ) på den 8-armade PEG-polymeren med avslutande N 3 -delar för att bilda en stabil 1, 2, 3-triazol. Christoffersson et al. fullbordade kemiska reaktioner under fysiologiska förhållanden för att bilda hydrogelerna med inställbara viskoelastiska egenskaper. Tvärbindningsstrategin var idealisk för att tillverka hydrogeler för 3D-cellodling; eftersom cellerna kunde inkapslas i biomaterialet utan att kompromissa med deras livsduglighet och var lämpliga för användning i mikrofluidiska enheter. Forskarna använde överskott av SPAAC-delar på det nya biomaterialet för att fästa olika ligander inklusive RGD-peptider för att främja interaktioner vid gränssnittet mellan cell och material.
Därefter, forskarna varierade sammansättningen av de två huvudbeståndsdelarna för att förstå de resulterande viskoelastiska egenskaperna, såsom lagringsmodulen (G') och förlustmodulen (G") för hydrogelerna via oscillerande reologi (teknik för att mäta det viskoelastiska beteendet hos mjuka material). De kontrollerade gelningskinetiken för den nya hydrogelen vid ökande temperaturer. Gelningskinetik för det nya biomaterialet var tillräckligt långsamt för homogen cellfördelning men tillräckligt snabbt för att förhindra cellsedimentering. Förmågan att kontrollera gelbildningskinetik gjorde det möjligt för forskarna att överväga en mängd olika biotillverkningsstrategier (t.ex. bioprinting) och hydrogelsammansättning inom mikrofluidsystemen för organ-på- chipapplikationer.
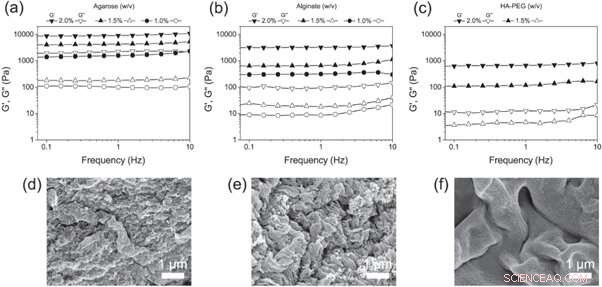
(a)–(c) Frekvenssvep av (a) agaros, (b) alginat och (c) HA-PEG-hydrogeler i olika koncentrationer. (d)–(f) SEM-mikrofotografier av (d) agaros, (e) alginat och (f) HA-PEG-hydrogeler som visar morfologin för varje hydrogel. Kreditera: Biotillverkning , doi:https://doi.org/10.1088/1758-5090/aaf657
Christoffersson et al. jämförde sedan HA-PEG-hydrogelerna med de väletablerade 3D-cellodlingsställningarna - agaros- och alginathydrogeler. För att bestämma de slutliga viskoelastiska egenskaperna lämpade för 3D-cellodlingsexperiment, de använde oscillerande reologi för att undersöka de olika polymerkoncentrationerna. Forskarna analyserade sammansättningen av det färdiga materialet med hjälp av bilder med svepelektronmikroskopi (SEM).
Lever-på-ett-chip-designen och installationen måste uppfylla två nyckelkriterier i studien:
1. Tillåt perfusion (passage av vätska) av cellodlingsmedium över hydrogelytan för ett stadigt utbyte av näringsmedia, till och från de inkapslade hepatocyterna.
2. Tillåt provtagning av det perfunderade mediet för experimentell analys under pågående cellodling, utan att påverka hepatocyterna och hydrogelen.
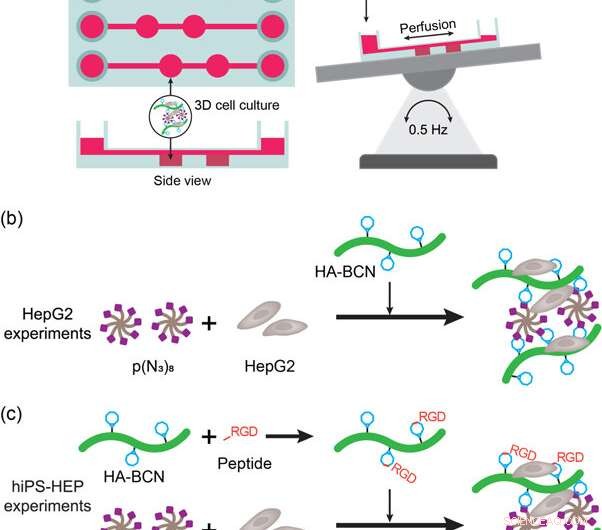
(a) Schematisk representation av lever-på-ett-chip-enheten och inställningen. Enheten sattes på ett automatiskt vippbord för att möjliggöra perfusion av media och näringsämnen under cellodling. (b) Avbildning av HepG2 3D-cellodlingsexperiment med HA-PEG-hydrogeler. HepG2-cellerna sattes till mediasuspenderad p(N3)8 före tillsats av HA-BCN. (c) Avbildning av hiPS-HEP 3D-cellodlingsexperiment med HA-PEG-hydrogeler. HiPS-HEP-cellerna sattes till mediasuspenderad p(N3)8 före tillsats av HA-BCN. I experiment med antingen linRGD- eller cRGD-peptid, HA-BCN förinkuberades med 1 μM av motsvarande peptid i 1 timme innan HA-BCN(RGD)-komponenten tillsattes till hiPS-HEP/p(N3)8-blandningen. Kreditera: Biotillverkning , doi:https://doi.org/10.1088/1758-5090/aaf657
För att uppfylla dessa kriterier, forskarna använde en kommersiell 3D-cellodlingsenhet (μ-Slide III 3D Perfusion IbiTreat) som innehöll två på varandra följande kammare (2 x 30 µL) i tre parallella arrayer - var och en ansluten till mediareservoarer för att perfusera vätska. För effektiv perfusion, de monterade enheten på ett automatiskt gungbord genom att vända perfusatriktningen över de hydrogelinnehållande kamrarna. Den experimentella uppställningen tillät perfusion genom enheten, uppfylla de första kriterierna. För att uppfylla det andra kriteriet, de lokaliserade väggarna intill hydrogelkamrarna gjorde det möjligt för forskarna att prova perfusatet utan att störa hydrogelen eller cellbeståndsdelarna.
Forskarna undersökte först biofunktionalisering av lever-på-ett-chip-enheter i studien med HEPG2-celler (leverkarcinomcellinje) inkapslade i hydrogeler, efter 3, 7 och 9 dagars cellodling. De jämförde cellmorfologin, viabilitet och funktionalitet med agaros och alginathydrogeler. Studien inkluderade analyser av levande/döda för att bekräfta cellviabilitet och ytterligare bekräftade HepG2-funktionalitet genom att detektera albumin- och ureasekret i supernatanten av cellkulturen.
För förbättrad cellfunktionalitet (ytfästning och rörlighet på material), forskarna ympade celladhesionsmotiv såsom linjära eller cykliska RGD-peptider (linjär linRGD eller cyklisk cRGD) på hydrogelerna. I det här fallet, hiPS-HEP-celler (hepatocytstamceller) odlades över olika hydrogelkompositioner i 13 dagar för att undersöka morfologin och livsdugligheten (levande/död färgning) efter cell-material-interaktioner. Forskarna använde sex olika hydrogelbaserade biomaterialytor i experimenten inklusive; 2D (HEP-beläggning), Agarose, Alginat, HA-PEG, HA-PEG (linRGD) och HA-PEG (cRGD).
HiPS-HEP-cellerna inkapslade och odlade i den modifierade hydrogelen växte inom 2D och sanna 3D-konstruktioner. För att testa funktionaliteten hos de odlade hiPS-HEP-cellerna (stamceller), forskarna kvantifierade deras utsöndring av albumin och urea. Resultaten visade att endast supernatanterna från stamceller odlade i 2D-ytor och i närvaro av cRGD-motivet utsöndrade hydrogeler albumin.
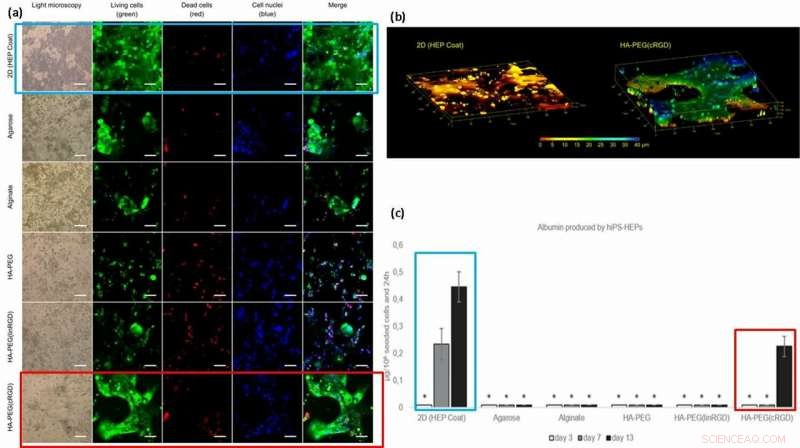
(a) Viabilitet och morfologi för hiPS-HEP-celler efter 13 dagars odling. Cellviabilitet verkar vara beroende av cellens förmåga att fästa vid ytan, hydrogelen, eller till varandra. Stora strukturer av hiPS-HEPs bildades i HA-PEG(cRGD). (kalcein, grön), döda celler (etidiumhomodimer-1, röd), och kärnor (Hoechst 33 342, blå). (b) Z-stack av bilder erhållna med konfokalmikroskopi avslöjar den platta formen av hiPS-HEPS när den odlas på ett 2D-substrat (vänster) jämfört med 3D-konstruktionerna av cellerna i en HA-PEG (cRGD) hydrogel (höger). Färgerna representerar höjden ovanför 3D-cellodlingsenhetens kammarbotten, dvs Z-axeln, från 0 μm (röd) till 40 μm (blå). (c) Albumin producerat av hiPS-HEP på HEP Coat i 2D och i de olika hydrogelerna. * indikerar att albuminkoncentrationsnivåerna var för låga för tillförlitlig kvantifiering. Kreditera: Biotillverkning , doi:https://doi.org/10.1088/1758-5090/aaf657
Baserat på resultaten, forskarna tillskrev den högre albuminmängden på 2D HEP-beläggningen till graden av albumin-diffusion i hydrogeler; överföring över 2D-skikt är snabbare än 3D. Den högre koncentrationen av albumin med cRGD-motiv bundna hydrogeler, korrelerade med den ökade celltillväxten och viabiliteten som observerades på de cRGD-bundna biomaterialytorna. Som ett resultat, forskarna har för avsikt att använda cykliska former av RGD-peptid för att hjälpa hepatocytstamcellsodling på hydrogeler förberedda för lever-på-ett-chip-enheter i framtiden.
På det här sättet, studien detaljerade fördelarna med att använda hyaluronan-PEG-baserad hydrogel modifierad med RGD-peptider för 3D-kulturer av hepatocyter (ungefär 13 dagar) i en lever-på-ett-chip-uppsättning. Som riktmärken för studien, Christofferfsson och medarbetare använde de allmänt tillgängliga alginat- och agaroshydrogelerna. I framtiden, forskarna kommer att optimera de viskoelastiska egenskaperna och koncentrationen av cellvidhäftningsmotiv på HA-PEG-hydrogelsystemet för biomimetisk cytokompatibilitet. The optimized hydrogel system can be combined with the device setup to facilitate physiologically relevant liver-on-a-chip platforms for clinical research in drug toxicology, drug discovery and regenerative medicine.
© 2019 Science X Network