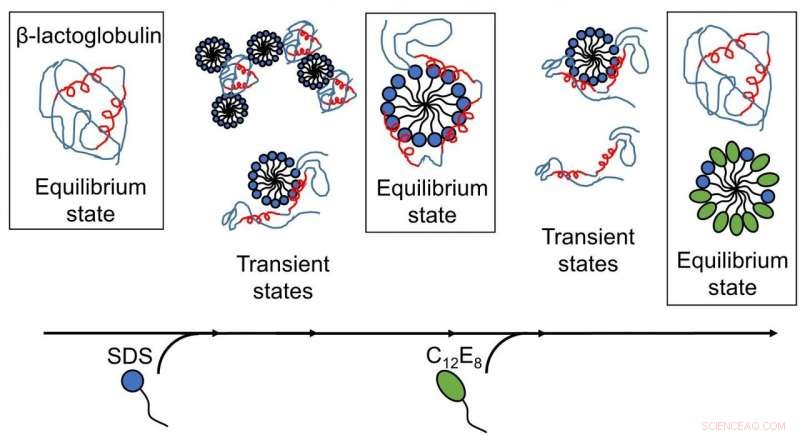
Resultat publicerade av AU-forskare avslöjar att surfaktantmedierad utveckning och återveckning av proteiner är komplexa processer med flera strukturer närvarande, och omarrangemang sker på tidsskalor från submillisekunder till minuter. (Bild:Återges med tillstånd från Royal Society of Chemistry). Kreditera: Chem Sci , upphovsrätt 2020 Royal Society of Chemistry.
Att förstå interaktionerna mellan proteiner och tvålmolekyler (ytaktiva ämnen) har länge varit viktigt för industrin, speciellt inom tvättmedel och kosmetika. Det anjoniska ytaktiva medlet natriumdodecylsulfat (SDS) är känt för att veckla ut klotformiga proteiner, medan det nonjoniska ytaktiva ämnet oktaetylenglykolmonododecyleter (C12E8) gör motsatsen, d.v.s. det hjälper proteiner att vikas till form igen.
För att tvättmedel ska fungera effektivt, det är viktigt att de ytaktiva medlen inte ändrar strukturen hos proteiner (enzymer), eftersom varje förändring i enzymstrukturen dödar deras förmåga att bryta ner fläckar och ta bort smuts. De flesta tvättpulver innehåller blandningar av ytaktiva ämnen som gör att enzymerna förblir aktiva. Också, vissa biotekniker utnyttjar ytaktiva ämnen i kombination med proteiner.
Membranproteiner sitter vanligtvis i cellmembranet. För att extrahera dem från denna miljö för olika studier, de måste solubiliseras av ytaktivt ämne. Det ytaktiva ämnet måste vara "snällt" och endast täcka den del av proteinet som införts i membranet så att deras struktur bevaras. I kontrast, när man karakteriserar molekylvikten för proteiner i labbet, en standardteknik är att veckla ut dem med det aggressiva negativt laddade ytaktiva ämnet, SDS, och övervaka hur de migrerar i en polymergel i ett elektriskt fält. Denna teknik fungerar bara om det ytaktiva medlet vecklar ut proteinerna helt och förstör deras struktur.
Det finns fortfarande debatt om vilken typ av interaktioner mellan proteinet och det ytaktiva ämnet som är viktigast. Är det de elektrostatiska interaktionerna mellan laddningarna av det ytaktiva medlet och proteinet, eller är det helt enkelt egenskaperna hos gränsytan mellan aggregaten (miceller) som de ytaktiva ämnena bildar i vatten, vilka är ansvariga för utvecklingen av proteinet?
Även om utvecklingen har studerats i detalj på proteinnivå, en fullständig bild av interaktionen mellan protein och ytaktivt ämne saknas i dessa processer. Denna brist på kunskap tas upp i det aktuella arbetet med att använda det globulära proteinet β-laktoglobulin (bLG) som ett modellprotein.
Rätt kombination av experimentella tekniker
Djupare insikter i utveckning och återveckning av proteiner erhölls, eftersom de olika stegen av interaktioner mellan ytaktivt ämne och proteiner kartlades som en funktion av tiden. För det första, modellproteinet, bLG, Blandades med det anjoniska ytaktiva medlet SDS medan man följde tidsutvecklingen av bildningen av komplex mellan protein och ytaktiva molekyler på millisekunders-minuters tidsskalan. Genom detta har forskarna bestämt strukturen hos de utvecklande komplexen. Därefter kartlade de tidsförloppet för återveckningsprocessen när icke-laddat ytaktivt ämne (C12E8) tillsattes till ett prov innehållande komplex av SDS och protein.
För att observera hur proteinet omarrangeras under utvecklingen och återveckningsprocessen som induceras av ytaktiva ämnen, kompletterande spektroskopiska tekniker, cirkulär dikroism och tryptofanfluorescens, användes i kombination med tidsupplöst röntgenspridning med liten vinkel (SAXS).
Cirkulär dikroism och tryptofanfluorescens övervakar förändringar i strukturen hos bLG, medan förändringar i den övergripande formen av protein-tensidkomplexen följdes av synkrotron SAXS. Denna kombination av tekniker har inte använts tidigare för att studera dessa processer.
Komplexa processer som varar från millisekunder till minuter
Utvecklingen av proteinet med SDS var en homogen process, där alla proteinmolekyler följer samma utvecklingsväg. SDS-komplexen (micellerna) attackerar proteinmolekylerna frontalt och viker sedan gradvis ut proteinet så att det bildar ett skal runt SDS-micellen. Återveckningen startar när C12E8-miceller "suger ut" SDS från protein-SDS-komplexet för att bilda blandade SDS-C12E8-miceller. Dock, själva återveckningsprocessen verkar följa flera vägar, eftersom flera strukturer befanns bildas parallellt, nämligen protein-tensidkomplex (förmodligen innehållande både SDS och C12E8), blandade miceller av SDS och C12E8, "nakna" proteiner vecklas ut som långa polymerkedjor, och ordentligt vikta proteiner. Experimentet gjorde det möjligt att följa interkonversionen mellan dessa arter, so that it could be determined which of the processes are fast and which ones are slow. The folded protein could form both from the naked unfolded proteins (quickly) and from protein-surfactant complexes (more slowly). Således, the best way in which surfactants can help a protein to fold is to basically get out of the way and let the protein find its own way back to the folded state.
The results have provided deeper insight into the structural changes occurring at the protein-surfactant level. They revealed that surfactant-mediated unfolding and refolding of proteins are complex processes of rearrangements occurring on time scales from below milliseconds to minutes and involve intimate collaboration between surfactant complexes and proteins.