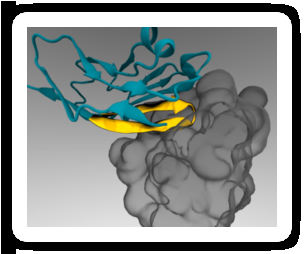
Ett minimalt peptid-"pass" (gult) kan fästas på terapeutiska nanopartiklar så att det binder till en immuncellsreceptor (grå) och förhindrar uppslukning. Kredit:Diego Pantano
Forskare har hittat ett sätt att smyga nanopartiklar som bär tumörbekämpande läkemedel förbi celler i immunsystemet, som normalt skulle uppsluka partiklarna, hindra dem från att nå sitt mål. Tekniken drar fördel av det faktum att alla celler i människokroppen visar ett protein på sina membran som fungerar som ett specifikt "pass" för att instruera immunceller att inte attackera dem. Genom att fästa en liten bit av detta protein till nanopartiklar, forskare kunde lura immunceller i möss att känna igen partiklarna som "själv" snarare än främmande, därigenom öka mängden medicin som levereras till tumörer.
Cancer nanoteknik
Nuvarande tillvägagångssätt för kemoterapi lämnar patienter med allvarliga biverkningar eftersom anti-cancerläkemedel som är avsedda att förstöra tumörer oavsiktligt dödar friska celler i kroppen. Men forskare har nyligen utvecklat nanopartiklar som kan transportera giftiga mediciner direkt till tumörer samtidigt som de skonar frisk vävnad. På grund av deras ringa storlek, nanopartiklar flyr från läckande blodkärl som är karakteristiska för tumörer och ansamlas i cancervävnaden. Tumörceller tar upp partiklarna som släpper ut deras giftiga innehåll när de väl kommer in. Detta lokaliserade tillförselsystem tillåter läkare att ge patienter högre doser av mediciner än vad som normalt tolereras.
Tidigare försök har gjorts för att avvärja attacker från immunsystemet genom att belägga nanopartiklar tätt med polyetylenglykol (PEG) "borstar" som fysiskt blockerar vidhäftningen av proteiner som normalt sätter sig på främmande kroppar för att locka makrofager. Medan dessa borstar fördröjer uppkomsten av immunsvaret, de förhindrar det inte.
Inspirationen till Dischers genombrottsarbete går tillbaka tretton år när en grupp forskare visade med genetiskt modifierade möss att ett protein som heter CD47 – som finns i cellmembranen hos nästan alla däggdjur – interagerar med en receptor på makrofager som kallas SIRPa, och, genom att göra så, signalerar att cellen är infödd och inte bör förstöras. Fynden hängde på att ta bort mus CD47 och väckte många frågor, inklusive hur sådana möss överlever och om det fanns relevans för människor.
Discher, som konstruerade nanopartiklar som självmonterar till olika former vid tiden för upptäckten, insåg att CD47-SIRPa-mekanismen för självigenkänning kunde, i princip, utnyttjas för att hjälpa nanopartiklar att smyga förbi immunförsvaret. Men det var också tydligt att mänskliga versioner av renade proteiner behövde studeras för översättning till människor.
2008, Dischers labb visade att human CD47 fungerar på samma sätt som mus CD47 som en "markör för sig själv" via signalering genom SIRPa-receptorn. Kort därefter, en grupp forskare klargjorde den kombinerade strukturen av mänskligt CD47 och SIRPa i atomär detalj. Dischers labb använde denna information för att utföra datorsimuleringar och identifiera den minsta delen av CD47 som fortfarande kunde binda till SIRPa. Resultatet blev en kort peptid som Dischers labb syntetiserade kemiskt och fäste till standard nanopartiklar.
"Att reducera CD47 till en essentiell peptid var ett nyckelsteg, ", sade Discher. "Sekvensering av tusentals mänskliga genom runt om i världen har nyligen avslöjat många variationer i sekvenserna för CD47 och SIRPa. Vi behövde konstruera en "universell" peptid som kunde binda SIRPa och fungera i alla människor trots dessa skillnader."
Stealth-nanopartiklar undviker immunsvar
För att testa om deras peptid kan hjälpa nanopartiklar att undvika immunförsvaret, Dischers team injicerade både peptidbundna nanopartiklar och nanopartiklar som saknade CD47 i möss. Båda typerna av nanopartiklar innehöll ett fluorescerande färgämne som gjorde det möjligt för forskarna att spåra partiklarna. I en artikel publicerad den 22 februari, 2013 in Vetenskap , forskarna rapporterade att på bara trettio minuter efter injektion av partiklarna, mössens blod innehöll fyra gånger så många nanopartiklar som innehöll CD47-peptid som partiklar utan peptiden, vilket tyder på att CD47-bundna partiklar sågs av makrofager som att likna celler som hörde hemma i kroppen.
Uppmuntrad av dessa första resultat, laget fyllde sedan sina CD47-bundna nanopartiklar, samt PEG-belagda nanopartiklar utan CD47, med anticancerläkemedlet paklitaxel plus en tumörriktad antikropp. Teamet injicerade separat båda typerna av nanopartiklar såväl som Cremophore - standardbäraren för paklitaxel - i möss med mänskliga tumörer. Efter bara en dag, tumörerna i möss injicerade med CD47-bundna nanopartiklar var 70 % av storleken på de som injicerades med de PEG-belagda nanopartiklarna. Dessutom, CD47-bundna nanopartiklar var lika bra eller bättre på att krympa tumörerna som Cremophore utan att orsaka några biverkningar. Teamet fortsatte med att dokumentera de molekylära förändringarna som sker inuti makrofager när CD47 hämmar uppslukning, föreslår att ytterligare mediciner kan användas för att hämma clearance.
"Kliniska prövningar med nanopartiklar för att leverera läkemedel mot cancer pågår för närvarande, men immunsystemets eliminering är fortfarande ett betydande hinder, sa Karen Peterson, Ph.D., Senior rådgivare för extramural program på NIBIB. "Dischers arbete är ett elegant tillvägagångssätt, som skulle kunna göra det möjligt för andra nanoterapeutika att vara effektiva i kliniska prövningar genom att tillhandahålla en molekylär "autentisering" som kroppen inte känner igen som främmande."
Peterson noterade också kombinationen av bioteknik och datormodellering som gick till att generera peptiden; Dischers förmåga att testa funktionen hos peptider av olika storlek via datorsimulering först, och sedan producera en konstgjord peptid baserad på dessa simuleringar tillät honom att eliminera en del av gissningsleken, sparar tid och pengar på lång sikt.
Framtida applikationer
Discher spekulerar i att hans CD47-peptid på liknande sätt skulle kunna användas för att förhindra immunclearance av virus som används för att leverera gener för genterapibehandling eller för att förbättra biokompatibiliteten och hållbarheten hos större främmande föremål som pacemakers och implantat, vars delar kan försämras med tiden på grund av attacker från immunsystemet.