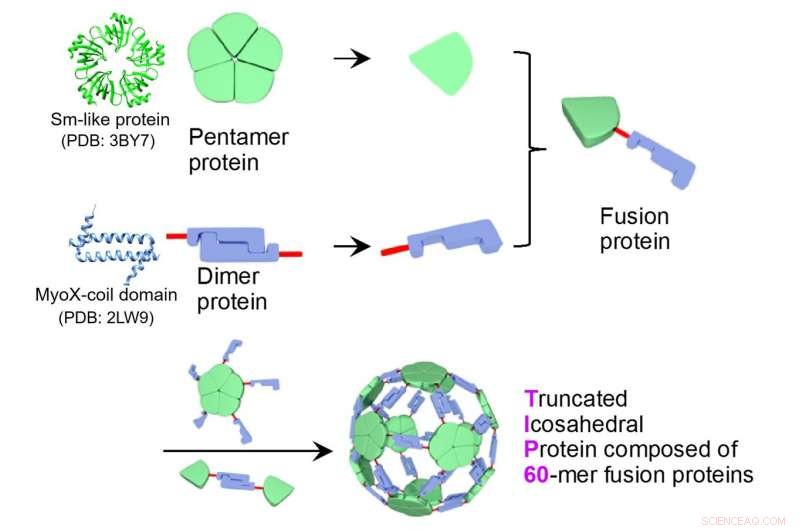
Sextio fusionsproteiner av ett pentameriskt Sm-liknande protein (PDB ID:3BY7) och en dimer MyoX-spoldomän (PDB ID:2LW9) sätts samman till ett proteinnanopartikelkomplex, TIP60 (Truncated Icosahedral Protein som består av 60-mer fusionsproteiner). Kredit:Reproducerad från Icosahedral 60-merisk porös struktur av designad supramolekylär proteinnanopartikel TIP60, Ryoichi Arai et al., Chem. Commun ., 2021, med tillstånd från Royal Society of Chemistry.
Nanopartiklar och nanocages är attraktiva material som kan appliceras i färgämnen, katalysatorer, och läkemedelstillförsel. För verklig användning, det är nödvändigt att producera ett stort antal nanopartiklar av enhetlig storlek och form, men hittills, Metoder för bildning av nanopartiklar med metaller har forskats mycket, och bildandet av nanopartiklar med en viss form och storlek har realiserats. Dock, det är inte lätt att skapa en grupp enhetliga nanopartiklar med samma struktur på atomnivå.
En gemensam forskargrupp ledd av docent Ryoichi Arai (Institutet för biomedicinska vetenskaper och fakulteten för textilvetenskap och teknologi, Shinshu University) och biträdande professor Norifumi Kawakami (fakulteten för naturvetenskap och teknik, Keio University) utvecklade en enhetlig och användbar supramolekylär proteinnanopartikel symmetriskt självmonterad från fusionsproteiner av en pentamerisk proteindomän och en dimer proteindomän. Det är möjligt att modifiera funktionaliteten genom platsspecifik mutagenes eller kemisk modifiering. Denna designade proteinnanopartikel med en diameter på cirka 22 nm fick namnet TIP60 (Truncated Icosahedral Protein som består av 60-mer fusionsproteiner) eftersom det bildas genom att självmontera 60-mera artificiella fusionsproteiner formade som en fotboll.
I föreliggande studie, den gemensamma forskargruppen löste den detaljerade tredimensionella strukturen av TIP60 med enpartikelkryoelektronmikroskopi. En stor mängd TIP60 uttrycktes i E. coli, och ett renat prov observerades vid kryo-elektronmikroskopanläggningen som drivs av prof. Masahide Kikkawa-labb vid University of Tokyo. Genom att utföra enpartikelanalys baserad på erhållen bilddata, en tredimensionell karta rekonstruerades med en upplösning på 3,3 Å. Det avslöjades att TIP60 bildar ihåliga sfäriska nanopartiklar som designats och har en ikosaedrisk 60-merisk struktur med 20 triangulära porer med en kant på ca 4 nm vardera. Dessutom, gruppen klargjorde i detalj den karakteristiska tredimensionella strukturen, såsom länken som förbinder pentamerbildningsdomänen och dimerbildningsdomänen sammansatt av en a-helix.
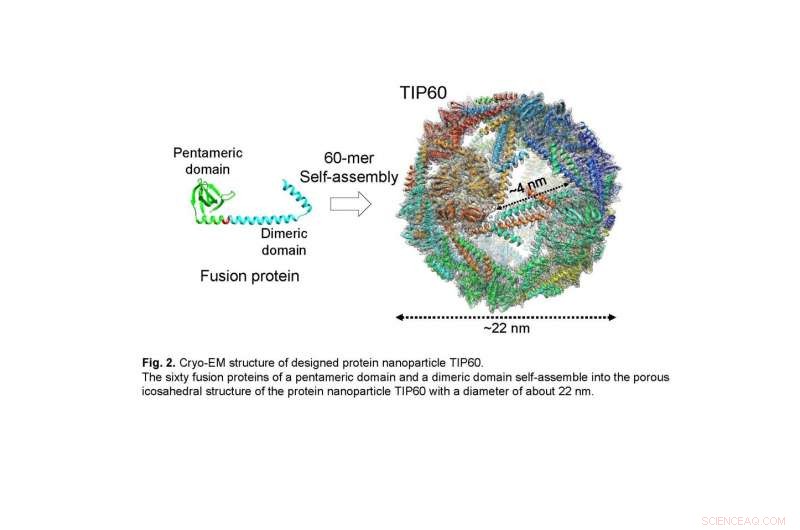
De sextio fusionsproteinerna i en pentamer domän och en dimer domän sammanfogar själv till den porösa ikosaedriska strukturen av proteinnanopartikeln TIP60 med en diameter på cirka 22 nm. Kredit:Ryoichi Arai, Shinshu universitet
När en liten molekylförening tillsätts efter att endast den yttre ytan av TIP60 modifierats med en högmolekylär förening, den lilla molekylföreningen kommer in i den inre kaviteten och modifieras kemiskt i den inre ytan. Med andra ord, det visade sig att den porösa strukturen hos TIP60 fungerar som ett filter genom molekylstorlek, och de yttre och inre ytorna av TIP60 kan modifieras kemiskt med olika molekyler av olika storlekar.
I framtiden, gruppen kommer att använda artificiellt designade proteinnanopartiklar genom att utveckla designen och funktionell modifiering av platsspecifika varianter baserat på den tredimensionella strukturen av TIP60 som belysts i denna studie. Det förväntas leda till utveckling och tillämpningar inom nanobioteknik och nanomaterialfält, såsom användning som en nanokapsel för ett läkemedelstillförselsystem.
Forskningen publicerades i Kemisk kommunikation .