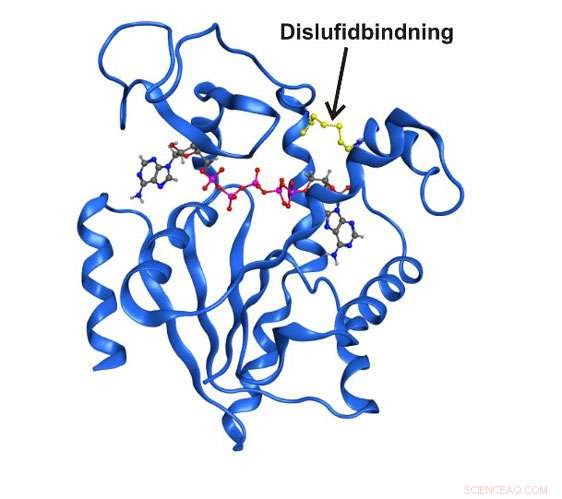
Högupplöst röntgenstruktur av enzymet adenylatkinas fångat i ett övergående strukturellt tillstånd av en kovalent disulfidbindning. Kredit:Umeå universitet
Kemister vid Umeå universitet har lyckats kartlägga strukturer och funktioner hos ett transient enzymtillstånd. Genom att modifiera enzymet adenylatkinas, forskare kunde isolera molekylen och studera den med hjälp av de kvantitativa teknikerna röntgenkristallografi och kärnmagnetisk resonans (NMR) spektroskopi. Resultaten har publicerats i tidskriften PNAS .
"Vi har nu kommit ett steg närmare en allmän förståelse av hur enzymer fungerar. Detta är avgörande för framtida design av nya enzymer i biotekniska tillämpningar, säger Magnus Wolf-Watz, docent vid kemiska institutionen vid Umeå universitet.
Biologiskt liv är beroende av ett stort antal cellulära, kemiska reaktioner som ofta är extremt långsamma och kan ta månader eller år att genomföra. För att kemiska och biologiska tidsskalor ska matcha, kemiska reaktioner påskyndas i celler med användning av enzymer som effektiva biokatalysatorer.
Under det senaste decenniets forskning har det klargjorts att enzymstrukturer som endast existerar kortvarigt och övergående kan vara helt avgörande för den katalytiska funktionen. Än så länge, det har inte varit möjligt att studera dessa tillstånd i detalj på grund av det enkla faktum att de är osynliga för traditionella spektroskopiska tekniker. Nu, forskare vid Kemiska institutionen vid Umeå universitet i Sverige har lyckats fånga ett övergående tillstånd centralt för funktionen i det essentiella enzymet adenylatkinas. Det kortsiktiga tillståndet var möjligt att berika genom att byta ut två aminosyror i enzymet med den reaktiva aminosyran cystein.
"Det är första gången som någon har lyckats studera ett övergående enzymtillstånd direkt med hjälp av spektroskopiska och kvantitativa tekniker. Med användning av våra metoder, vi kunde i detalj beskriva både strukturen och funktionen av enzymet i den specifika övergående fasen, säger Magnus Wolf-Watz, som ledde studien tillsammans med postdoc Michael Kovermann, som nu innehar en gruppledning vid universitetet i Konstanz i Tyskland.
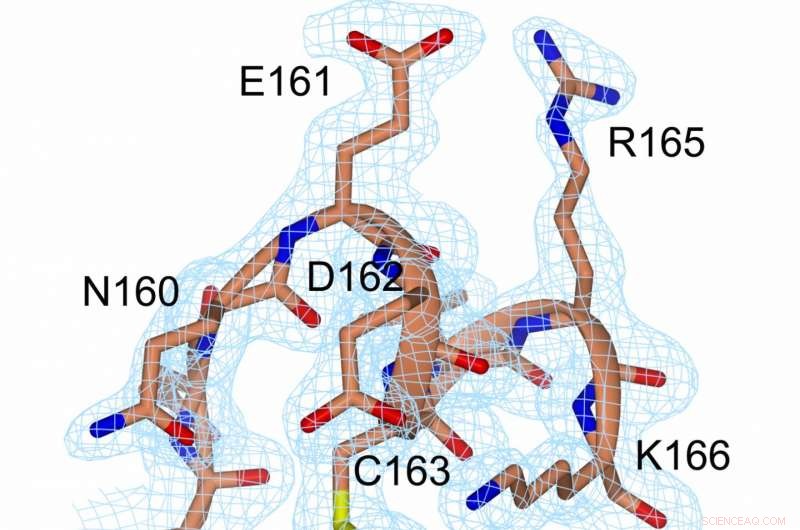
En representation av elektrondensitet vid disulfidbindningen (gul, mellan C56 och C163) och i dess närhet. Kredit:Prof. Michael Kovermann, Universitetet i Konstanz
Resultaten visade att funktionen i ett enzym är helt beroende av dess inneboende dynamik, och utan dynamik skulle enzymet göras oanvändbart. Vidare, det visade sig att det övergående tillståndet band dess substratmolekyler mycket starkare än de naturliga proteinerna. Resultaten gav oss ytterligare ledtrådar om hur enzymer kan påskynda reaktioner med en sådan otrolig specificitet och effektivitet. Hela tiden, metoden som vi utvecklade kan vara allmänt användbar i studier av andra enzymer."
Magnus Wolf Watz NMR-team har samarbetat med röntgenkristallograferna Uwe H. Sauer och Elisabeth Sauer-Eriksson i studien.
"Vi har haft ett långvarigt och mycket produktivt samarbete. Det här är ett bra exempel på hur viktig den samarbetsanda som finns vid Umeå universitet är, och hur vi bör vårda och vidareutveckla den i framtiden, säger Magnus Wolf-Watz.