Peptidhäftning. Kredit:University of Leeds
Brittiska forskare har skapat en ny metod för att strukturera peptider, vilket de säger kommer att bli billigare och göra processen att använda häftade peptider i läkemedelsupptäckten mycket mer allmänt tillgänglig.
Metoden utvecklad av det nio man starka teamet vid University of Leeds, och utnyttja syntetisk kemi utvecklad vid University College London, är mer mångsidig, billigare, helt reversibel och resulterar i peptider vars farmakokinetiska egenskaper, som löslighet kan enkelt ställas in, enligt professor Andrew Wilson, som ledde studien.
Tillvägagångssättet kan tillåta skickliga forskare att begränsa en peptid, leverera den till en viss cell och sedan frigöra den, hindrar den från att lämna cellen igen.
Gör peptider mer användbara
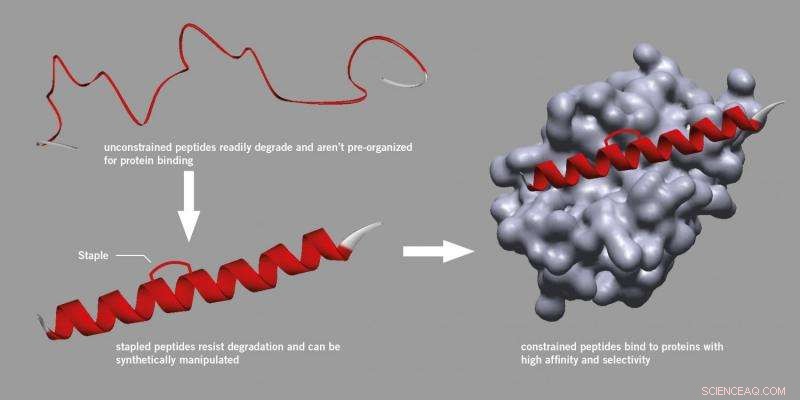
Forskare och läkemedelstillverkare betraktar i allmänhet peptider med skepsis, att tro att de är för opålitliga för att användas som droger eftersom de lätt bryts ned i celler och är svåra att manipulera.
Men forskning initierad vid Harvard University hittade en metod för att introducera en stag som kunde fästas till en peptid, stärka dess aktiva struktur och göra den mer stabil och mindre benägen att brytas ned.
Denna process, känd som "häftning" använder en specifik syntetisk metod och har nu blivit ett erkänt tillvägagångssätt för upptäckt av peptidläkemedel, till och med resulterat i nystartade företag. Häftade peptider bryts inte ned, binder bättre till proteiner och har förbättrade farmakokinetiska egenskaper som cellupptag.
Protein-protein interaktioner
En omfattande förändring i perspektiv på peptider har uppstått på grund av behovet för läkemedelsindustrin att utveckla läkemedel som verkar på protein-proteininteraktioner, i motsats till det traditionella "lås-och-nyckel"-metoden för igenkänning som utnyttjas av de flesta nuvarande droger. Små molekyler som verkar på protein-proteininteraktioner måste täcka en större mindre konvex yta.
Professor Wilson, vars team arbetar med detta problem, "Forskare har haft begränsad framgång med att utveckla traditionella små molekyler som verkar på protein-proteininteraktioner, och att utveckla peptider på detta sätt är ett attraktivt alternativ."
Han tillade:"De mycket högre nivåerna av kontakt mellan peptiden och proteinet kan utnyttjas för att uppnå högre affinitet och selektivitet, så vi har blivit entusiastiska över detta alternativa tillvägagångssätt för häftning."
Naturligt förekommande aminosyror
Teamet från University of Leeds har tagit principen om peptidhäftning till en ny nivå. Metoden är baserad på reaktionen av två tioler i en peptidsekvens med ett dibrommaleimidreagens.
När de två tiolerna är korrekt placerade i peptidsekvensen resulterar reaktionen i att strukturen blir låst i en specifik och bioaktiv spiralform som är mer stabil.
Metoden fungerar på peptidsekvenser som innehåller de naturliga och vanliga aminosyrorna cystein eller homocystein. Detta kommer att tillåta tillgång till lämpliga peptider via rutinmässiga kemiska och biologiska metoder.
Professor Wilson, från University of Leeds School of Chemistry och Astbury Center for Structural Molecular Biology sa:"Vår metod för proteinhäftning är mer flexibel, potentiellt billigare, och bör vara lättare att använda i kemisk biologi och läkemedelsupptäckt.
Hela forskningsartikeln Double Quick, Double Click Reversible Peptide 'Stapling' publiceras i Royal Society of Chemistry's Kemivetenskap tidning den 31 maj 2017.
Dr Michael Webb, Docent i organisk kemi vid University of Leeds, sa:"Vi har utvecklat en ny metod för att snabbt införa en funktionell begränsning i två modellpeptider som förbättrar en rad biofysikaliska och biokemiska egenskaper. Till skillnad från andra metoder kan den också vändas.
"Detta tillvägagångssätt kan utföras med naturligt tillgängliga aminosyror, potentiellt föra peptidhäftning till ett större samhälle.
"Förmågan att vända begränsningen kan möjliggöra leverans av peptidbaserade reagens till cellen där de kan vara obegränsade och vara mindre lätta att transportera tillbaka ut igen."