En modell av ett beräkningsmässigt utformat miniprotein från en storskalig studie från UW Medicine Institute for Protein Design. Kredit:UW Medicine Institute for Protein Design
Scenen är redo för en ny era av datadriven proteinmolekylär ingenjörskonst när framsteg inom DNA-syntesteknologi går samman med förbättringar i beräkningsdesign av nya proteiner.
Denna veckas Vetenskap rapporterar det största testet av vikningsstabilitet för beräkningsdesignade proteiner, möjliggörs av en ny metod med hög genomströmning.
Forskarna kommer från UW Medicine Institute for Protein Design vid University of Washington i Seattle och University of Toronto i Ontario.
Huvudförfattaren till tidningen är Gabriel Rocklin, en postdoktor i biokemi vid University of Washington School of Medicine. Seniorförfattarna är Cheryl Arrowsmith, av Princess Margaret Cancer Center, Structural Genomics Consortium och Institutionen för medicinsk biofysik vid University of Toronto, och David Baker, UW professor i biokemi och en utredare från Howard Hughes Medical Institute.
Proteiner är biologiska arbetshästar. Forskare vill bygga nya molekyler, inte hittas naturligt, som kan utföra uppgifter för att förebygga eller behandla sjukdomar, i industriella tillämpningar, inom energiproduktion, och i miljösanering.
"Dock, beräkningsmässigt utformade proteiner misslyckas ofta med att bilda de vikta strukturerna som de designades för att ha när de faktiskt testas i labbet, " sa Rocklin.
I den senaste studien, forskarna testade mer än 15, 000 nydesignade miniproteiner som inte finns i naturen för att se om de bildar veckade strukturer. Även stora proteindesignstudier under de senaste åren har i allmänhet endast undersökt 50 till 100 mönster.
"Vi lärde oss enormt mycket i den här nya skalan, men smaken har gett oss en ännu större aptit, ", sa Rocklin. "Vi är angelägna om att testa hundratusentals mönster under de närmaste åren."
De senaste testerna ledde till designen av 2, 788 stabila proteinstrukturer och kan ha många biotekniska och syntetiska biologitillämpningar. Deras ringa storlek kan vara fördelaktigt för att behandla sjukdomar när läkemedlet behöver nå insidan av en cell.
Proteiner är gjorda av aminosyrakedjor med specifika sekvenser, och naturliga proteinsekvenser kodas i cellulärt DNA. Dessa kedjor viks till 3-dimensionella konformationer. Sekvensen av aminosyrorna i kedjeguiden där den kommer att böjas och vridas, och hur delar kommer att samverka för att hålla samman strukturen.
I årtionden, forskare har studerat dessa interaktioner genom att undersöka strukturerna hos naturligt förekommande proteiner. Dock, naturliga proteinstrukturer är vanligtvis stora och komplexa, med tusentals interaktioner som tillsammans håller proteinet i sin vikta form. Att mäta bidraget från varje interaktion blir mycket svårt.
Forskarna åtgärdade detta problem genom att beräkningsmässigt utforma sina egna, mycket enklare proteiner. Dessa enklare proteiner gjorde det lättare att analysera de olika typerna av interaktioner som håller alla proteiner i sina vikta strukturer.
"Fortfarande, även enkla proteiner är så komplicerade att det var viktigt att studera tusentals av dem för att lära sig varför de viker sig, " sa Rocklin. "Detta hade varit omöjligt tills nyligen, på grund av kostnaden för DNA. Varje designat protein kräver sin egen anpassade bit av DNA så att det kan göras inuti en cell. Detta har begränsat tidigare studier till att endast testa tiotals konstruktioner."
För att koda deras design av korta proteiner i detta projekt, forskarna använde det som kallas DNA-oligobiblioteksyntesteknologi. Det utvecklades ursprungligen för andra laboratorieprotokoll, såsom stor gensammansättning. Ett av företagen som tillhandahållit sitt DNA är CustomArray i Bothell, Wash. De använde också DNA-bibliotek tillverkade av Agilent i Santa Clara, Kalifornien, och Twist Bioscience i San Francisco.
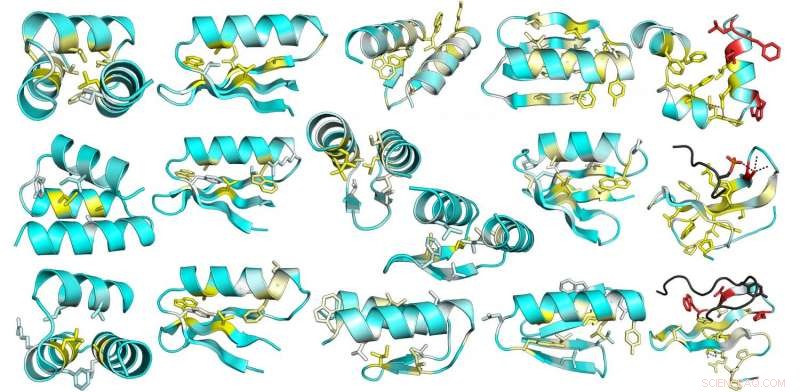
Denna bild är från en omfattande mutationsanalys av stabilitet i designade och naturliga proteiner. Den genomsnittliga förändringen i stabilitet på grund av att mutera varje position i 13 designade proteiner avbildas på designmodellstrukturerna. Gul indikerar positioner där mutationer är mest destabiliserande; positioner där det finns liten effekt är blå. Kredit:UW Medicine Institute for Protein Design
Genom att upprepa beräkningscykeln och experimentell testning över flera iterationer, forskarna lärde sig av sina designmisslyckanden och förbättrade successivt sin modellering. Deras framgångsgrad för design steg från 6 procent till 47 procent. De producerade också stabila proteiner i former där alla deras första design misslyckades.
Deras stora uppsättning av stabila och instabila miniproteiner gjorde det möjligt för dem att kvantitativt analysera vilka proteinegenskaper som korrelerade med veckning. De jämförde också stabiliteten hos deras designade proteiner med liknande storlek, naturligt förekommande proteiner.
Det mest stabila naturliga proteinet som forskarna identifierade var ett mycket studerat protein från bakterien Bacillus stearothermophilus. Denna organism solar sig i höga temperaturer, som de i varma källor och termiska öppningar i havet. De flesta proteiner förlorar sina vikta strukturer under så höga temperaturer. Organismer som trivs där har utvecklat mycket stabila proteiner som förblir vikta även när de är varma.
"Totalt 774 designade proteiner hade högre stabilitetspoäng än detta mest proteasresistenta monomera protein, " konstaterade forskarna. Proteaser är enzymer som bryter ner proteiner, och var väsentliga verktyg som forskarna använde för att mäta stabiliteten för sina tusentals proteiner.
Forskarna förutspår att när DNA-syntesteknologin fortsätter att förbättras, proteindesign med hög genomströmning kommer att bli möjlig för större, mer komplexa proteinstrukturer.
"Vi går bort från den gamla stilen av proteindesign, som var en blandning av datormodellering, mänsklig intuition, och små bitar av bevis om vad som fungerade tidigare." Rocklin sa. "Proteindesigners var som mästare som använde sin erfarenhet för att handskulptera varje del i sin verkstad. Ibland fungerade saker, men när de misslyckades var det svårt att säga varför. Vår nya metod låter oss samla in en enorm mängd data om vad som gör proteiner stabila. Dessa data kan nu driva designprocessen."