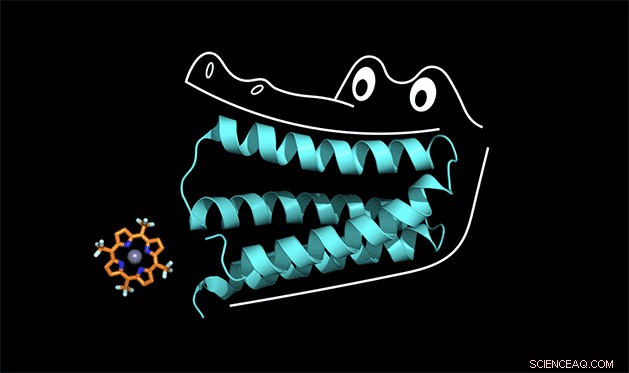
Det syntetiska proteinet klämmer fast på porfyrinet som en alligators käkar. Upphovsman:Nicholas Polizzi
Proteiner har förmågan att turbo-ladda biokemiska reaktioner inuti kroppen.
Utan hjälp av proteintyper som kallas enzymer, reaktionen som bygger DNA kan ta över 130, 000 år att slutföra. Enzymer minskar den tiden till bara några millisekunder.
För att öka kemiska reaktioner, många proteiner samarbetar med mindre molekyler eller metaller som kallas kofaktorer. Kemister vill designa proteiner som binder till icke-biologiska kofaktorer för att påskynda kemiska reaktioner som inte finns i naturen. Men först, de måste ta reda på hur man skapar konstgjorda proteiner som fäster till nya kofaktorer på exakt rätt sätt, och det är ingen lätt grej.
Ett team av kemister vid Duke och UC San Francisco är de första som löser detta pussel med proteindesign. Teamet skapade ett syntetiskt protein som tätt binder en icke-biologisk katalysator, en typ av molekyl som kallas porfyrin som kan stjäla elektroner från andra molekyler när den absorberar ljus.
"Att kunna kombinera konstgjorda katalysatorer med proteiner skulle vara riktigt stort inom kemifältet för då kan du kombinera kraften hos ett enzym med reaktionen som inte finns i naturen, "sade före detta hertig doktorand Nicholas Polizzi, som nu är postdoktor i William DeGrados laboratorium vid UCSF.
"Vi kunde räkna ut de designkriterier som var nödvändiga för att placera detta porfyrin i ett protein med en mycket hög noggrannhet, "Polizzi sa." Det var en riktigt stor språngbräda för att kunna designa nya proteinkofaktorkombinationer som inte syns i naturen. "
Proteiner är gjorda av kedjor av hundratals eller tusentals mindre aminosyror som vrider sig och går ihop till komplexa 3D-former som kan samsas med andra molekyler som bitar av ett pussel. För att katalysera kemiska reaktioner, proteinkofaktorkombinationer rymmer två eller flera molekyler i exakt formade fickor som håller molekylerna i precis rätt positioner, och ge rätt miljö, för att en kemisk reaktion ska inträffa.
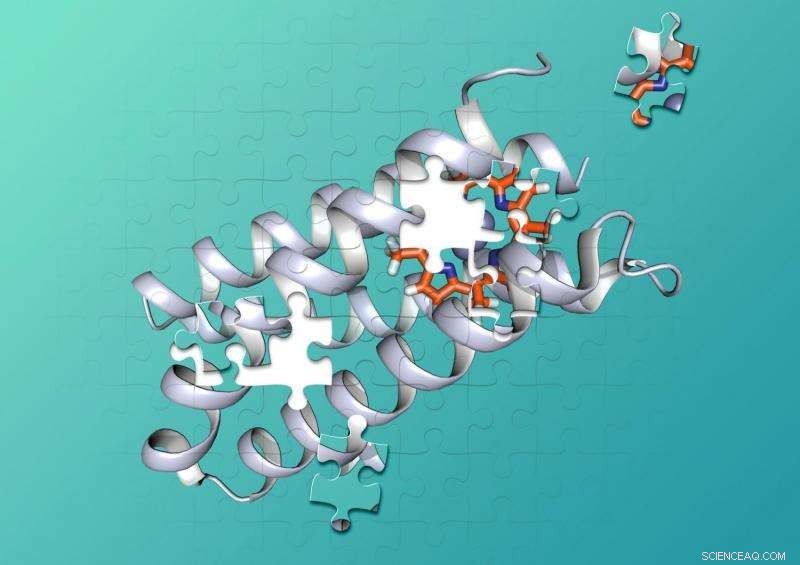
Kemister vid Duke och UCSF utformade ett syntetiskt protein som tätt binder en icke-biologisk molekyl. Upphovsman:Nicholas Polizzi
Miljontals år av evolution har skapat proteiner som fälls in i de former som tätt griper specifika kofaktorer och ger de perfekta miljöerna för att katalysera kemiska reaktioner.
I över 25 år har kemister har använt det de vet om proteinvikning för att designa syntetiska aminosyrasekvenser som vrids till användbara former. Men hittills, de har inte kunnat designa ett protein som binder en icke-biologisk kofaktor med den precision som krävs för att driva komplexa nya kemiska reaktioner.
Polizzi sa att detta kan bero på att dessa konstruktioner främst fokuserade på "bindningsstället" där kofaktorer och reagerande molekyler passar in i proteinet, samtidigt som man ignorerar resten av strukturen. "Det jag gjorde annorlunda är att jag i huvudsak betraktade hela proteinets inre som bindningsstället för porfyrinet, i motsats till bara några få aminosyror som berör porfyrinet, "Sa Polizzi.
För att förstå hur detta fungerar, du kan tänka på proteinet som en alligators mun, sa Michael Therien, William R. Kenan Jr. Professor i kemi vid Duke. Proteinet hakar fast på en kofaktor på samma sätt som en alligator använder sina framtänder för att chompa ner på middagen. Men för att framtänderna ska få ett starkt grepp, käken och baktänderna måste också utformas korrekt.
"Det nya konceptet här är att proteinets icke-bindande region hålls i en form som gör att bindningsregionen kan arbeta, "Sa Therien.
"Vi kallade proteinet" gator "i labbet, "Sa Polizzi.
Gatorproteinets käkar klämmer fast så hårt på porfyrinkofaktorn att hela strukturen är för stel för att katalysera en reaktion, Sa Polizzi. Men med några justeringar för att lossa strukturen, han tror att han kan få det att fungera.
"I denna reaktion, ofta behöver du lite vickelrum i proteinet för att det ska röra sig. Och det fanns inget vrickrum i vårt protein, allt passade för perfekt, "Sa Polizzi.