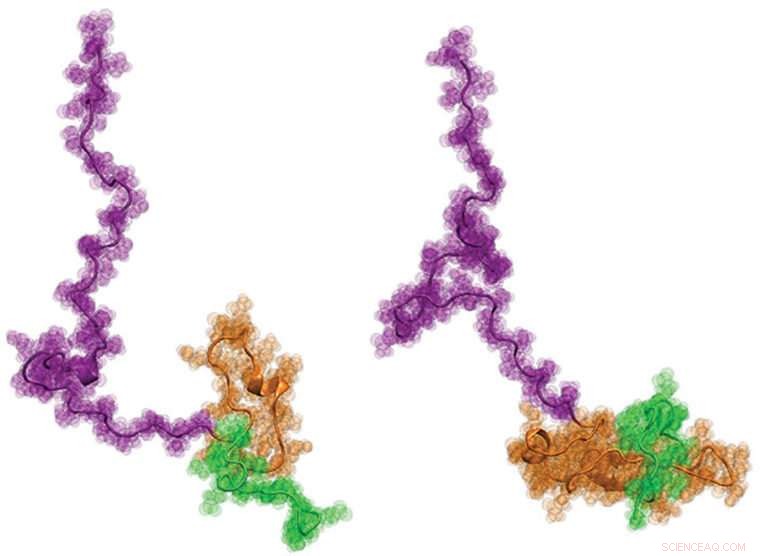
En internationell kohort av forskare, inklusive ingenjörer från Washington University i St. Louis, visade nyligen Huntingtons protein för första gången. Man hoppas att kunskap om strukturen-som har en grodyngelliknande form-kan hjälpa till att bättre informera utvecklingen av nya behandlingar för sjukdomen. Upphovsman:Washington University i St. Louis
Huntingtons sjukdom är en progressiv, dödlig neurodegenerativ störning som orsakas av mutationer i en specifik gen som kallas huntingtin (Htt). Under de 20 plus åren sedan Htt-genen identifierades, forskare har fokuserat på proteinet som kodas av Htt -genen, kallas Httex1. Detta protein ackumuleras i hjärnan hos patienter med Huntingtons sjukdom, och den rådande hypotesen har varit att den genomgår en dramatisk strukturell förändring när en repetitiv kanal av aminosyran glutamin muterar till en avvikande lång region känd som den mutationellt expanderade polyglutamin (polyQ) kanalen.
Nu, för första gången, laget av Hilal A. Lashuel vid Ècole Polytechnique Fèdèrale de Lausanne (EPFL) i Schweiz; Edward A. Lemke vid European Molecular Biology Laboratory (EMBL) i Tyskland; och Rohit V. Pappu vid Washington University i St. Louis har avslöjat en detaljerad strukturell beskrivning av Htt som en funktion av polyQ -längd. Verket publicerades nyligen i Journal of the American Chemical Society .
En studie i tre steg
Att säkra strukturella beskrivningar på atomnivå av Htt i full längd och sjukdomsrelevanta proteinfragment som kallas Httex1 har varit utmanande eftersom dessa molekyler håller fast vid varandra och hämmar genereringen av rena proteinprover för strukturstudier. "Det är mycket svårt att få strukturell karakterisering av proteiner i en mos, "sa Pappu, Edwin H. Murty professor i teknik vid teknikhögskolan.
"Vårt mål var att få insikt i hur ökning av längden på polyQ-svansen upprepning förändrar strukturen hos detta protein på monomernivå och under förhållanden där vi kan koppla bort dess vikning och självmontering, "sa Lashuel, professor i biovetenskap och chef för laboratoriet för kemisk biologi vid neurodegeneration vid EPFL.
I studiens första steg, Lashuel och postdoktor John B. Warner IV använde nya kemiska strategier i sitt laboratorium för att ta fram exakta, högrenhetsprover av Htt för molekylär spektroskopi. Men dessa kom bara i ultralåga koncentrationer och erfordrade tekniker för att undersöka enskilda molekyler. Warner och Lashuel möjliggjorde dessa experiment genom att generera prover med platsspecifika fluorescerande etiketter.
För det andra steget i projektet, Warner och Lashuel arbetade med Lemkes laboratorium vid EMBL för att utföra enmolekylär Förster (eller fluorescens) resonans energiöverföring (smFRET), som är en teknik som kan mäta avstånd mellan 1-10 nanometer inom enskilda molekyler-i detta fall, inom enskilda Htt -proteiner. Denna del av studien gav den första kvantitativa bedömningen av hur de interatomära avstånden inom Httex1 varierar med expansionsmutationerna.
Till sist, forskarna arbetade med Pappus laboratorium vid Washington University, där den utvecklade nya datormodelleringsmetoder för att producera fysiskt korrekta, strukturella modeller på atomnivå av Httex1 som bäst passar alla enkelmolekyldata från de två föregående stegen. Resultaten var förvånande:Den övergripande strukturen för Httex1 liknar en grodyngel.
Tadpole -effekten
"Arkitektoniskt, Httex1 är grodyngelformad, med ett globulärt polyQ -huvud och en diskett svans, "Sa Pappu." När polyQ -längden blir längre, grodyngelns huvud blir större i sin yta. Denna ökade ytarea på huvudet verkar ge upphov till interaktioner som annars inte borde finnas i celler. "
Upptäckten utmanar de mångåriga idéerna om Httex1 -ackumulering vid Huntingtons sjukdom. "Om den rådande hypotesen var sann, "Sa Pappu, "då skulle grodyngel ha förvandlats till en" groda "när polyQ -längden ökar över tröskellängden, men så verkar det inte vara. De nya resultaten fokuserar istället vår uppmärksamhet på de nya cellulära interaktionerna som får mer funktion som drivs av grodyngelstrukturen med ett större polyQ-huvud. "
"Även om den rådande hypotesen gynnat en modell där mutant huntingtininducerad toxicitet främst drivs av dess benägenhet att fälla ihop och aggregera, våra resultat tyder på att avvikande interaktioner på monomernivå också kan bidra till initiering och/eller progression av sjukdomen, "Sa Lashuel.
"Detta fynd gör att vi kan undersöka vilka regioner av detta protein som är viktiga att rikta in oss på, och modulera dess toxicitet på ett specifikt sätt, "sade Kiersten M. Ruff, en postdoktor i Pappus laboratorium som utformade datasimuleringarna och är den första författaren på tidningen.
Nästa utmaning för forskarna är att förstå hur dessa strukturförändringar på monomernivån i Httex1 leder till ökad aggregering och toxicitet när längden på polyQ -svansen passerar den patogena tröskeln.
"Nyckeln har varit centraliteten i samarbetet mellan tre team med kompletterande och icke-överlappande expertis, alla delar ett engagemang för att främja vetenskap, "Sa Lashuel.