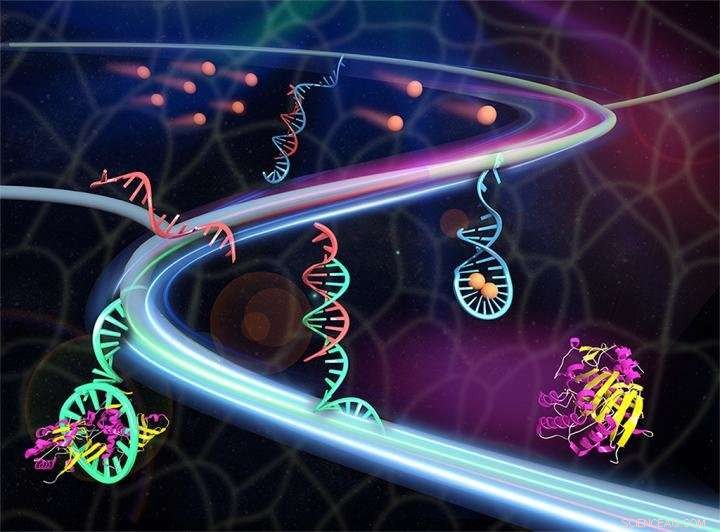
En syntetisk vävnad frigör terapeutiska proteiner (rödbrun/gul) en gång utlöst av metaboliter (sandbrun). Metaboliterna kommer i kontakt med det dubbelsträngade DNA (rött/blått) för att frigöra det röda utlösande DNA:t. Det utlösande DNA:t aktiverar aptamer (cyan) -proteinkomplexet för att frigöra proteinet. Upphovsman:Xin Zou/Jinping Lai (Penn State)
Ett artificiellt system som använder en DNA-snörad hydrogel kan ta emot en kemisk signal och släppa ut lämpligt protein, enligt forskare från Penn State. Ytterligare stimulering av den kemiska signalen fortsätter att utlösa ett svar.
En hydrogel är ett nätverk av polymerkedjor som drar till sig vatten och kan användas för att simulera biologisk vävnad.
Många system i celler och i människokroppen är uppbyggda med en signal- och responsväg. En av de mest kända är glukos, ett litet socker som utlöser frisättning av insulin.
Vi har bara gjort detta nyligen i en petriskål, "sa Yong Wang, professor i biomedicinsk teknik. "Vi gjorde tester med glatta muskelceller, men vi skulle naturligtvis vilja göra detta i ett levande djur. "
Forskarna rapporterar i novembernumret av Kemisk vetenskap , "Med rationell design, detta biomimetiska hydrogel -system skulle utgöra en allmän plattform för att styra utsignalen från signalproteiner för mångsidiga potentiella applikationer som läkemedelsleverans, cellreglering, molekylär avkänning och regenerativ medicin. "
Hydrogeln, tillverkad av polyetylenglykol, är infunderad med två olika typer av DNA. Den ena är en aptamer - en kort DNA -sträng som fäster vid kemikalien som forskarna vill släppa ut i cellen. När det gäller glukos och insulin, aptamer skulle binda med insulin det "läkemedel" som forskarna vill släppa. Den andra typen är en dubbelsträngad spiralformig molekyl av DNA som valts för att reagera med metabolitsignalen-glukos-och initiera den kemiska frisättningen.
När signalmolekylen når en dubbel DNA -sträng, DNA separeras i två strängar. Den ena strängen binder med molekylen och den andra rör sig mot aptamer och tvingar den att släppa det protein som är bundet till den. Proteinet kan sedan röra sig genom cellerna till sitt normala bindningsställe och utföra sina normala åtgärder.
"Detta var inte en enkel process att skapa, "sa Wang." En doktorand arbetade med det i tre år innan han gav upp. Totalt, det tog fyra till fem år att komma så här långt. "Forskarna använde adenosin som signalkemikalie och trombocyt-härledd tillväxtfaktor som signalprotein som skulle frigöras. Systemet kan upprepa sekvensen, släppa ut signalproteiner tills det inte finns mer att släppa.
"Vi vet ännu inte hur vi enkelt ska fylla på proteinerna, sa Wang.
Forskarna testade hydrogelsystemet adenosin-PDGF-BB och fann att utan signalkemikalier, mängden signalprotein som frigörs av hydrogeln var mycket liten. När signalkemikalien - adenosin - applicerades, hydrogelen släppte ut cirka 28 procent av målsignalproteinet-PDGF-BB. Andra kemikalier som liknar adenosin, som guanosin och uridin orsakade inte frisättning av PDGF-BB från hydrogel.
"Så småningom skulle vi vilja använda detta system för kontrollerad läkemedelsleverans och andra biologiska åtgärder, sa Wang.