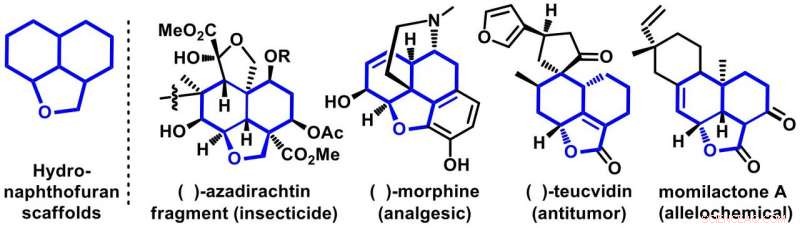
Figur 1. Representativa exempel på bioaktiva molekyler som har hydronaftofurans ställningar. Kredit:Osaka University
Forskare vid Osaka University utvecklade ett mycket effektivt sätt att producera kirala multicentrerade fusionerade tricykliska föreningar vars kärnstruktur ofta finns i bioaktiva föreningar inklusive läkemedel.
Kemister har ägnat enorma ansträngningar för att utveckla ett sätt att bygga molekyler som de vill. En enda enantiomer (specifikt speciellt arrangemang av atomer) är väsentligt för molekyler med specifika biomedicinska egenskaper på grund av den kirala naturen hos biologiska receptorställen (vanligtvis proteiner). Ett mycket utmanande mål inom organisk kemi är asymmetrisk syntes, selektiv framställning av en enda enantiomer av en molekyl.
Nyligen, kemister vid Osaka University har syntetiserat mycket enantioselektiva polycykliska kirala föreningar med flera kirala centra på ett elegant och selektivt sätt som kan öppna nya vägar inom forskning och industri.
I sin rapport i Naturkommunikation , Osaka-teamet fokuserade på att utveckla ett nytt och praktiskt sätt att syntetisera tricykliska molekyler, namngivna hydronaphthofurans. Dessa byggnadsställningar är rikliga i naturliga produkter av viktiga biologiska aktiviteter. De representativa medlemmarna i denna familj är morfin, azadirachtin, teucvidin och momilakton som är välkända för att visa en rad biologiska aktiviteter såsom smärtstillande, anti-tumör, insekticider, och allelokemikalier (Figur 1). Även om vissa finns i naturen, att förbereda dem i det syntetiska laboratoriet med fullständig kontroll av selektivitet är en stor utmaning för syntetiska kemister.
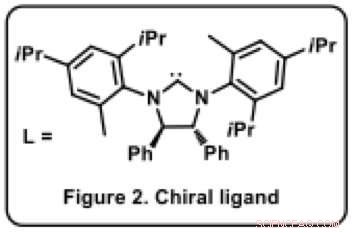
Figur 2. Kiral ligand. Kredit:Osaka University
En rapporterad syntes av en spansk grupp använde en organisk molekylbaserad kiral katalysator för att producera en tricyklisk ställning med tre kirala centra. Å andra sidan, Osaka-teamet antog en konceptuellt annorlunda strategi för att bygga den tricykliska ställningen med fem kirala centra (schema 1). Börjar med en billig råvara med bara en ring (fenoler), de använde en organometallisk nickelbaserad kiral katalysator för att konstruera ytterligare två ringar genom en reaktion som kallas oxidativ cyklisering (1 till 2). In situ förskjutning av nickel från en mellanprodukt 2 med en annan reaktiv molekyl av önskade substituenter gav en mängd olika hydronaftofuraner. Slutprodukten bildas som en enkel isomer och som innehöll minst fem kirala centra, fördelade på alla tre ringarna.
Ravindra Kumar, en i teammedlemmen förklarar, "Katalysatorn är nyckeln till kiral selektivitet, eftersom det är kiralt i sig." även om användningen av nickelkatalysatorer är utbredd i organisk syntes, ingen hade använt i denna reaktion tidigare. "I en organometallisk katalysator, det är avgörande att fästa en lämplig ligand [organisk molekyl, L*] till metallatomen för att bestämma reaktionsresultatet. Liganden är vanligtvis en skrymmande organisk molekyl med flera ringsystem (Figur 2). I vårat fall, det var en process av välgrundad trial-and-error för att hitta en lämplig ligand som gav den önskade produkten som en enda förening (av möjliga sexton) både i högt utbyte och med utmärkt kiral renhet.
Med lämplig katalysator i handen, teamet producerade framgångsrikt över tjugo föreningar i god avkastning och med 94 till 99 % enantioselektivitet av alla fem kirala centra – en spektakelprestation! Tolerans för ett brett spektrum av substituenter (R) (halogener, bensenringar och estrar) i den utvecklade metoden och närvaron av funktionaliserbar grupp (karbonyler och olefiner) utökar den potentiella syntetiska användbarheten av tricykliska produkter till bioaktiva molekyler efter funktionell gruppomvandling. Förutom att erbjuda utmärkt kiral renhet, reaktionen är också snabb och ekonomisk när det gäller utgångsråvaror, som är avgörande krav för att skala upp forskningen från laboratorie- till industriell produktion.
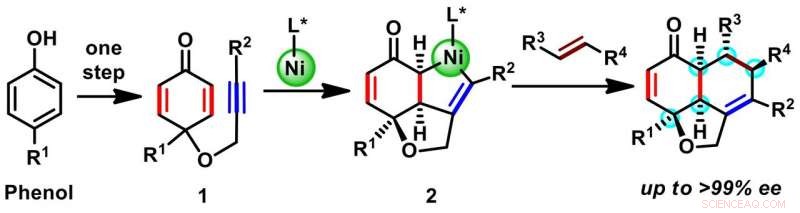
Schema 1. Tvåstegs enantioselektiv syntes av hydronaphthofurans ställningar. Kredit:Osaka University
"Dessa tricykliska produkter har traditionellt tillverkats genom stegvis ringkonstruktion, men det brukar vara långsamt och ineffektivt, " Sensuke Ogoshi, lagledaren, säger. "Vår direkta tvåstegscyklisering ger tillgång till en rad mycket användbara ställningar för naturprodukter. I det långa loppet, detta kunde inte bara förenkla produktionen av kända läkemedel, men kanske leda till upptäckten av nya föreningar med medicinska eller andra biologiska egenskaper."