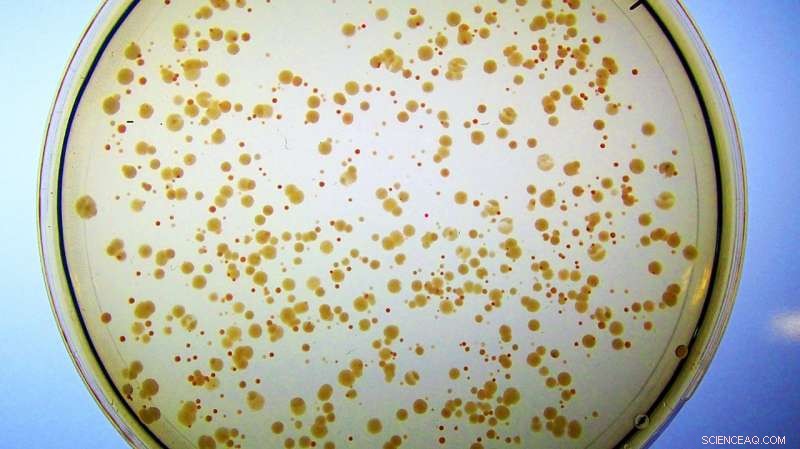
Kolonier av E. coli växer på järnrikt medium. Alla celler konstruerades för att förlora sitt naturliga Fes-enzym. De bildar små, ohälsosamma röda kolonier eftersom de ackumulerar järn bundet till enterobactin, och har knappt tillräckligt med fritt järn för att växa. I kontrast, celler som innehåller det artificiella enzymet Syn-F4 bildar stora, friska vita kolonier eftersom det nya proteinet katalyserar klyvningen av enterobaktin och efterföljande frisättning av järnet som behövs för en sund tillväxt. (Obs:Om dessa celler placerades på petriskålar med minimalt med järn, de röda kolonierna skulle inte dyka upp alls eftersom de inte skulle ha tillräckligt med fritt järn för att upprätthålla celltillväxt.) Kredit:Ann Donnelly/Hecht Lab/Princeton University
Ett gryende forskningsfält, konstgjord biologi, arbetar för att skapa en genuint ny organism. I Princeton, kemiprofessorn Michael Hecht och forskarna i hans labb designar och bygger proteiner som kan vika och efterlikna de kemiska processer som upprätthåller liv. Deras konstgjorda proteiner, kodas av syntetiska gener, är cirka 100 aminosyror långa, med ett oändligt varierande arrangemang av 20 aminosyror.
Nu, Hecht och hans kollegor har bekräftat att åtminstone ett av deras nya proteiner kan katalysera biologiska reaktioner, vilket betyder att ett protein som är designat helt från grunden fungerar i celler som ett äkta enzym.
Enzymer är nyckeln till all biologi, sa Hecht. "Biologi är systemet av biokemiska reaktioner och katalysatorer. Varje steg har ett enzym som katalyserar det, för annars skulle dessa reaktioner inte gå fort nog för att livet skulle existera. ... Ett enzym är ett protein som är en katalysator. De är de bästa katalysatorerna i universum eftersom evolutionen har ägnat miljarder år åt att välja ut dem. Enzymer kan öka hastigheten på en reaktion med många storleksordningar."
När Hecht och hans forskargrupp framgångsrikt hade skapat artificiella proteiner för E. coli, de började leta efter viktiga funktioner som de kunde störa i dessa enkla bakterier. De hittade fyra gener som, när den tas bort, skulle inte bara göra E. coli inert - effektivt död - utan som deras artificiella proteiner då kunde "rädda, " eller återuppliva.
De identifierade först dessa artificiella proteiner 2011, och de har ägnat de senaste sex åren åt att ta reda på exakta mekanismer genom vilka deras nya proteiner fungerade, nu detaljerad i en 15 januari tidning i Naturens kemiska biologi .
Det är viktigt att inte anta att ett artificiellt protein kommer att fungera på samma sätt som det naturliga proteinet vars radering det räddar, Hecht varnade.
Att bestämma mekanismerna som deras artificiella proteiner använde tog otaliga experiment. "Vi hade fyra olika gendeletioner - fyra olika enzymatiska funktioner, "sa Ann Donnelly, huvudförfattare på tidningen.
Efter år av experiment, laget hade kommit fram till att två av dessa "räddningar" fungerar genom att ersätta enzymer - proteiner som tjänar till att katalysera andra reaktioner, hjälpa dem att fungera tillräckligt snabbt för att upprätthålla liv - med proteiner som inte var enzymer själva, men som ökar produktionen av andra processer i cellen, Hon sa. Den tredje visade framsteg, men den fjärde hade frustrerat flera forskare som kom genom Hechts labb.
Men sen Donnelly, som var doktorand när hon gjorde forskningen och nu är forskningsspecialist i bioinformatik vid University of Pittsburgh, knäckt koden.
"Detta konstgjorda protein, Syn-F4, var faktiskt ett enzym, " sa Donnelly. "Det var ett otroligt och otroligt ögonblick för mig - otroligt till den grad att jag inte ville säga något förrän jag hade upprepat det flera gånger."
Hon berättade bara för Katie Digianantonio, en studiekamrat, och Grant Murphy, en postdoktor, som är medförfattare till den nya tidningen. "Jag sade, "Jag tror att det här är ett enzym." Jag visade dem de första uppgifterna och sa:”Säg inget till Michael. Låt mig göra det här igen. "Donnelly renade om proteinet, och skapade en ny, helt rent underlag för E. coli. "Jag körde allt igen från olika förberedelser - och när resultatet höll i sig, Jag sa till Michael, " Hon sa.
Av den ursprungliga uppsättningen proteiner som kan rädda genborttagningar, detta är det enda som har visat sig vara ett enzym - åtminstone hittills, Hon sa.
"Vi har ett helt nytt protein som kan upprätthålla livet genom att faktiskt vara ett enzym - och det är bara galet, " sa Hecht.
Detta har betydande konsekvenser för industrin, sa Justin Siegel, fakultetschef för Innovation Institute for Food and Health och en biträdande professor i kemi, biokemi och molekylär medicin vid UC Davis Genome Center, som inte var involverad i forskningen.
"Bioteknik använder vanligtvis enzymer för att utföra industriella processer för produktion av material, mat, bränsle och medicin, "Siegel sa. "Användningen av dessa enzymer i en industriell miljö börjar ofta med ett enzym som naturen utvecklats i miljarder år för ett orelaterade syfte, och sedan justeras proteinet för att förfina dess funktion för den moderna applikationen. Rapporten här visar att vi inte längre är begränsade till de proteiner som produceras av naturen, och att vi kan utveckla proteiner - som normalt skulle ha tagit miljarder år att utvecklas - på några månader."
Hechts team hade skapat en stam av E. coli som saknade enzymet Fes, utan vilken den inte kan komma åt det järn som behövs för att upprätthålla liv. "Vi behöver alla järn, " sa Hecht. "Även om järn är rikligt på jorden, biologiskt tillgängligt järn är det inte." Celler har utvecklat molekyler som enterobactin, han förklarade, som kan rensa järn från alla tillgängliga källor, men de behöver då ett verktyg — som Fes — för att lossa järnet från enterobaktinets hårda grepp.
Denna modifierade E. coli -stam hade inget sätt att extrahera, eller hydrolysera, järnet från dess enterobaktin, tills den "räddades" av Syn-F4. Forskarna hade gett järn till E. coli, men det färgade bara cellerna röda, eftersom även om de kunde samla den bundna metallen, de kunde inte befria det från enterobactin eller komma åt det för cellulärt bruk.
"Och sedan märkte Ann ... de är inte röda längre, de är vita, vilket tyder på att cellerna kan bryta ner detta och få järnet, vilket tyder på att vi faktiskt har ett enzym!" sa Hecht.
"Miljontals år av evolution resulterade i Fes, ett perfekt enzym för att hydrolysera enterobactin, sa Wayne Patrick, en universitetslektor i biokemi vid University of Otago i Nya Zeeland, som inte var involverad i forskningen. "Det är lätt nog att studera strukturen, funktion och mekanism hos Fes, och att sluta sig till något om dess utveckling genom att jämföra den med relaterade sekvenser. Men det är mycket svårare (och mer intressant) att fråga sig om Fes är lösningen på det biokemiska problemet med att hydrolysera enterobactin – eller om det är en av många lösningar. Donnelly et al. har visat att ett enzym som aldrig föddes (utom artificiellt, i deras labb) kunde ändå ha varit en lika bra lösning (hade det fått möjlighet).
"Detta resonemang har flera konsekvenser, " förklarade Patrick. "En är för det liv som återstår att upptäcka på jorden. Kanske en dag, vi hittar ett naturligt enzym som ser ut som Syn-F4 men som tar Fes plats i en eller annan mikroorganism. Åtminstone nu, vi vet att titta. En annan implikation är för astrobiologi. Om det finns många lika troliga lösningar på ett biokemiskt problem, det blir mer troligt att en lösning har hittats någon annanstans i universum."
Forskare är på gränsen till en sann syntetisk biologi, sa Hecht.
"E. coli har 4, 000 olika gener, " sa han. "Vi testade inte alla 4, 000, eftersom det enda sättet detta experiment fungerar är om ingenting växer på minimalt medium, och av de 4, 000, det är bara sant för vissa.
"Vi börjar koda för ett artificiellt genom. Vi har räddat 0,1 procent av E. coli-genomet ... För nu, det är en konstig E. coli med några konstgjorda gener som gör att den kan växa. Antag att du ersätter 10 procent eller 20 procent. Då är det inte bara en konstig E. coli med några konstgjorda gener, då måste du säga att det är en ny organism. "