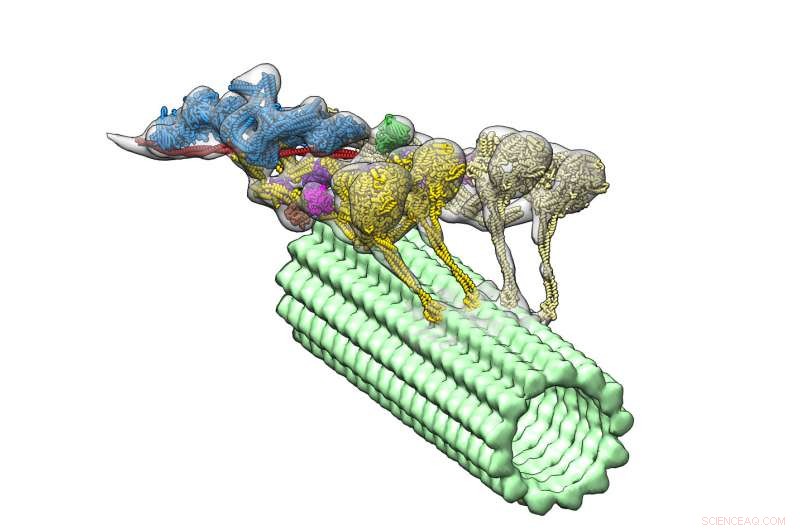
Dynein-dynaktinkomplexet (flerfärgat) driver ner en mikrotubuli (grön). De fyra motordomänerna visas i gult. Dynactin (blått) tillhandahåller ställningen för att hålla ihop de två dyneinerna. Kredit:Danielle Grotjohn, Lander Lab
På den mobila motorvägen, motorproteiner som kallas dyneiner styr vägen. Dyneiner "går" längs strukturer som kallas mikrotubuli för att leverera cellulär last, såsom signalmolekyler och organeller, till olika delar av en cell. Utan dynein på jobbet, celler kan inte dela sig och människor kan utveckla neurologiska sjukdomar.
Nu en ny studie, som står i journalen Naturens strukturella och molekylära biologi , ger den första tredimensionella (3D) visualiseringen av dynein-dynaktinkomplexet bundet till mikrotubuli. Studieledarna från The Scripps Research Institute (TSRI) rapporterar att ett protein som kallas dynactin kopplar ihop två dyniner, som ett ok som låser ihop ett par draghästar.
"Om du vill att ett hästspann ska röra sig i en riktning, du måste rada upp dem, säger Gabriel C. Lander, PhD, en TSRI docent och senior författare av studien. "Det är precis vad dynactin gör med dyneinmolekyler."
Att förstå hur dynein-dynactin-komplexet är sammansatt och organiserat ger en avgörande grund för att förklara de bakomliggande orsakerna till flera dynein-relaterade neurodegenerativa sjukdomar som spinal muskelatrofi (SMA) och Charcot-Marie-Tooth (CMT) sjukdom.
Forskare visste att dynactin krävs för att dynein ska kunna flytta last, men de kämpade för att få en helhetsbild av hur de olika delarna av komplexet fungerade tillsammans.
"Vi visste att dynein bara blir aktivt när det binder till en partner som heter dynactin. Problemet var att, historiskt sett, det var svårt att lösa denna struktur eftersom den är väldigt flexibel och dynamisk, " förklarar Danielle Grotjahn, en TSRI doktorand och medförfattare till studien. "Vi behövde visualisera dessa dynein-dynactin-komplex för att i grunden förstå hur det fungerar att transportera molekyler."
För den nya studien, forskare använde en avbildningsteknik som kallas kryo-elektrontomografi, som liknar att skaffa en datortomografi av ett protein, att producera en 3D-rekonstruktion, eller tomogram. För att öka upplösningen och klarheten hos dessa tomogram, forskare använde avancerade beräkningsalgoritmer för att sätta ett genomsnitt av många individuella proteinkomplex.
I detta fall, dock, de nuvarande bearbetningsmetoderna kunde inte producera en tydlig, tolkningsbar 3D-struktur av det extremt flexibla dynein-dynactin-komplexet.
Grotjahn visste att den nödvändiga informationen gömdes i tomogrammen, så hon utvecklade en ny strategi för att identifiera specifika komponenter i dynein-dynactin-komplexet. Detta tillvägagångssätt hjälpte till att styra bildbehandlingsprogrammet för att rekonstruera hela det mikrotubulibundna motorkomplexet.
"Danielle tog det första stora steget för beräkningsalgoritmerna, säger Lander.
Med sina nya, detaljerad struktur, forskarna märkte en överraskande egenskap:komplexet har två dyneinmolekyler där de förväntade sig att bara se en. Detta betyder att varje dynein har två motordomäner, dynein-dynaktinkomplexet har totalt fyra motoriska domäner.
"Denna upptäckt var helt oväntad, och kommer att förändra hur detta motorkomplex representeras i cellbiologi och biokemi läroböcker, " säger Saikat Chowdhury, PhD, en TSRI-forskare och medförfattare till studien.
"Det hade varit år av biofysiska experiment och biokemiska experiment, och det antogs alltid att det bara fanns en dyneinmolekyl, ", tillägger Lander.
Forskarna kunde också se var dynaktin passade in. De fann att molekylen ger en stabil ställning, koppla ihop teamet av motoriska domäner och aktivera deras förmåga att röra sig längs mikrotubuli. Denna upptäckt hjälper till att förklara hur dynein kan dra stora laster, såsom organeller som är mycket större än de själva, över långa avstånd i en trång cellulär miljö.
Bildbehandlingsmetoden som används i denna studie har potential att vara extremt användbar för att lösa strukturerna hos andra stora, flexibla proteiner.
"Vi kan nu gå förbi tecknade modeller och visualisera de fina detaljerna i många dynamiska makromolekylära komplex, " säger Grotjahn. "När vi lär oss mer om 3D-organisationen och arkitekturen för dessa molekylära maskiner, vi kommer att vara bättre rustade för att förstå hur de inte fungerar vid sjukdom."
Ytterligare författare till studien, "Kryo-elektrontomografi avslöjar att dynactin rekryterar ett team av dyneiner för progressiv motilitet, " var Yiru Xu från The Scripps Research Institute; Richard J. McKenney från University of California, Davis; och Trina A. Schroer från Johns Hopkins University.