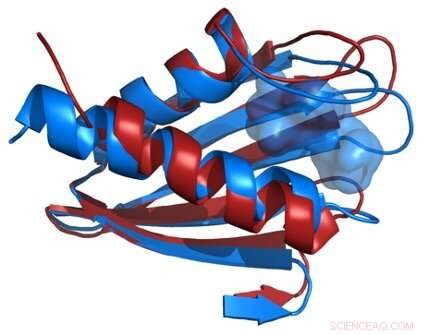
Jämförelse av strukturerna i Flpp3-proteinets ryggrad som härrör från en röntgenfri elektronlaser (röd) och från NMR (blå) avslöjar en inre hålighet som är unik för NMR-strukturen och därför tyder på förekomsten av mellanliggande proteinstrukturer. Upphovsman:James Zook
Tularemi är en sällsynt men ofta dödlig sjukdom. Det orsakas av en av de mest aggressiva patogenerna på jorden, bakterien Francisella tularensis. Mikroben, transporteras av en mängd olika djur och insekter, kan komma in och attackera kroppen genom en rad olika vägar, resulterar i olika konstellationer av symptom och svårighetsgrader.
Tularemi förblir dåligt förstådd och det finns inget säkert och effektivt vaccin mot sjukdomen. Den extrema dödligheten hos F. tularensis och dess potential att aerosoliseras har också gjort den till en biovapenkandidat, öka brådskan att förstå sjukdomen och utveckla effektiva behandlingar.
I en ny studie, forskare vid Biodesign Center for Applied Structural Discovery undersöker ett nyckelmembranprotein som är ansvarigt för bakteriens fantastiska förmåga att infektera kroppen och orsaka sjukdom. Denna virulensfaktor, känd som Flpp3, undersöks i oöverträffad detalj med hjälp av en röntgenfri elektronlaser eller XFEL, en massiv och kraftfull röntgenaccelerator som ligger vid SLAC National Accelerator Laboratory, Stanford.
XFEL-tekniken använder lysande och extremt korta röntgenblixtar för att undersöka kristalliserade prover av Flpp3, avslöjar proteinets detaljerade struktur som aldrig förr. Genom att jämföra den strukturella information som samlats in genom XFEL -experiment med tidigare strukturanalys med NMR, forskare har utvecklat en mer komplett modell av Flpp3:s genomarbetade form. (Tidigare studier har visat att när en gen som kodar för Flpp3 är inaktiverad, effekterna av patogenen F. tularensis minskas avsevärt.)
Forskare hoppas att så småningom använda denna information för att utveckla riktade läkemedel som kan störa proteinets virulensegenskaper och skydda mot tularemi. Framstegen i förståelsen kan också hjälpa forskare att utveckla ett effektivt vaccin mot sjukdomen i framtiden. För närvarande, det finns bara levande försvagade vacciner mot tularemi, och risker för infektion och otillräcklig immunitet i samband med detta tillvägagångssätt har förhindrat användning av sådana vacciner i USA.
Biodesignforskaren Dr. James Zook tillsammans med professorerna Petra Fromme och Abhishek Singharoy vid Biodesign Center for Applied Structural Discovery ledde den nya studien. Han får sällskap av internationella kollegor, inklusive forskare från DESY, SLAC, AstraZeneca, European Molecular Biology Laboratory i Grenoble, Frankrike, bland andra.
Petra Fromme, chef för Center for Applied Structural Discovery förklarar vikten av resultaten:"Denna studie kombinerar, för första gången, toppmodern XFEL -teknik med NMR och molekylär modellering för att riva upp det stora konformationsutrymmet för Flpp3. Studien avslöjar olika konformationer av detta viktiga protein för bakteriens virulens i XFEL- och NMR -strukturen och visar därigenom den mycket dynamiska naturen hos Flpp3. Denna studie är så spännande som den visar att väldigt olika konformationer samexisterar och omvandlas till varandra under fysiologiska förhållanden. "
Visualisera virulens
Med hjälp av detaljerade strukturella data från NMR och ny XFEL -analys av tularemivirulensfaktorn, forskarna identifierade en potentiell hämmare av Flpp3. Denna information erhölls från tillgängliga virtuella bibliotek som innehåller strukturer av läkemedelsfragment. Nästa, en fysikbaserad modelleringsmetod, känd som molekylär dynamik (MD), tillhandahållit detaljerad information om fluktuationer och konformationsförändringar av atomer och molekyler i det virulensbundna proteinet, hjälpa forskare att få en mer exakt läsning om Flpp3s struktur och beteende.
"Detta arbete ger flera atomupplösningsstrukturer av en viktig virulensfaktor från bakterien som orsakar tularemi, "enligt Biodesign -forskaren Dr. Debra Hansen, medförfattare till den nya studien. Proteinkonfigurationerna som identifieras kommer att hjälpa forskare att fortsätta strukturbaserad design av läkemedel som kan vara effektiva mot den svårfångade sjukdomen, genom inriktning och hämning av Flpp3.
Som medförfattare och biodesignforskare Dr Abhishek Singharoy förklarar, studien är anmärkningsvärd för att vara bland de första undersökningarna av proteinkonformationsflexibilitet som upptäcktes med seriell femtosekund-röntgenkristallografi och NMR och bekräftades med hjälp av molekylära dynamik (MD) simuleringar.
Gruppens resultat visas i det aktuella numret av tidningen Cell Press Strukturera .
Ihållande hot
Tularemi, även känd som kaninfeber, är en sällsynt infektionssjukdom, angriper vanligtvis ögonen, hud, lymfkörtlar och lungor efter infektion av bakterien F. tularensis. Sjukdomen är endemisk i Nordamerika såväl som i många delar av Europa och Asien, även om fall av tularemi är ovanliga och fullblåsta utbrott tenderar att begränsas till regioner med dålig sanitet och otillgänglighet för modern vård.
Tularemi drabbar främst däggdjur, särskilt gnagare, kaniner och harar, även om det ibland också infekterar fåglar, får, och husdjur, inklusive hundar, katter och hamstrar.
Sjukdomen kan spridas till människor genom insektsbett och direkt exponering för ett infekterat djur. Sjukdomen är extremt smittsam. Bara 10 bakterieceller kan vara dödliga och en enda bakterie kan vara tillräcklig för att orsaka infektion. Organismen kan leva i veckor i jord, vatten och döda djur.
Tularemi kan behandlas effektivt om det upptäcks tidigt, även om behandlingsregimen kan vara lång och komplex. De flesta infekterade med F. tularensis uppvisar symptom inom tre till fem dagar, även om det kan ta så lång tid som två veckor.
Sjukdomen finns i olika former med olika symptom, beroende på hur och var bakterierna kommer in i kroppen. Dessa inkluderar ulceroglandulär tularemi, den vanligaste formen, som producerar sår i huden vid infektionsstället, svullna och smärtsamma lymfkörtlar, feber, frossa, huvudvärk och utmattning.
Andra former inkluderar glandular, okuloglandulär, orofaryngeal, pneumonisk, och tyfoid tularemi. Om den lämnas obehandlad, en rad allvarliga komplikationer från sjukdomen kan uppstå, inklusive hjärnhinneinflammation, lunginflammation, irritation runt hjärtat och beninfektion.
Kristallmetod
I den aktuella studien, en teknik som kallas seriell femtosekundröntgenkristallografi används för att sondera strukturen hos Flpp3-proteinet. Här, korta och lysande röntgenstrålar, ungefär en miljard gånger ljusare än konventionella röntgenstrålar, slå en stråle av kristaller som "flyger" genom röntgenstrålen. Den intensiva röntgenstrålningen förstör kristallerna men innan du gör det, skapar ett diffraktionsmönster på en skärm. Röntgenpulserna är ultrakorta, varar bara 40 femtosekunder, att de överskrider röntgenskador, gör det möjligt att samla in data vid rumstemperatur under nära fysiologiska förhållanden. (1 fs =10 -15 sekunder eller en kvadriljarddel av en sekund.)
Att montera många av dessa röntgenbilder med hjälp av datorer gör det möjligt att montera detaljerade, 3D-struktur av proteinet som studeras. Denna så kallade diffraktion före förstörelse-metod var först banbrytande av Henry Chapman vid Deutsches Elektronen-Synchrotron (DESY) med teamet vid ASU under ledning av John Spence och Petra Fromme och deras medarbetare.
Forskarna kombinerade de nya XFEL -strukturdata med sina tidigare NMR -studier av Flpp3, observera två olika tillstånd av proteinet. MD -simuleringarna avslöjade en intern kavitetsstruktur som är övergående, vilket tyder på att Flpp3 genomgår en subtil konformationsförändring.
Tillvägagångssättet öppnar dörren till riktad läkemedelsutveckling som syftar till att minska dödligheten av tularemi och visar kraften i kombinerad teknik för att låsa upp detaljerna i proteinstruktur och dynamik.