
Sjöar i vulkaniska omgivningar kunde ha varit grogrunden för de första biokemiska föreningarna för cirka 4 till 4,5 miljarder år sedan. Kredit:Dhilung Kirat/Wikimedia, ETH Zürich
ETH-forskare har kunnat bevisa att en proteinstruktur som är utbredd i naturen – amyloiden – teoretiskt sett är kapabel att föröka sig. Detta gör den till en potentiell föregångare till molekyler som betraktas som livets byggstenar.
Länge betraktad som en biologisk aberration, amyloider är fibrösa aggregat av korta proteinfragment. Amyloider har ett dåligt rykte eftersom de tros vara orsaken till flera neurodegenerativa sjukdomar, inklusive Alzheimers, Parkinsons och Creutzfeldt-Jakobs sjukdom.
Det var först nyligen som forskare upptäckte att amyloider förekommer som strukturella och funktionella byggstenar i ett brett spektrum av livsformer, från bakterier, jäst och svampar till människor. Hos ryggradsdjur, de spelar en roll i produktionen av pigmentet melanin, medan jästceller använder amyloidaggregat för att bilda ett slags molekylärt minne.
Katalysatorer i prebiotisk evolution
Består av korta peptider, amyloidfibrer kan påskynda kemiska reaktioner på ett liknande sätt som enzymer; de har alltså i flera år betraktats som kandidater för livets första prekursormolekyler. Tills nu, dock, en viktig kemisk egenskap saknades i teorin om amyloidernas roll i abiogenes:självreplikation.
Tidiga förespråkare för amyloidhypotesen inkluderar ETH-professor Roland Riek och hans seniorassistent Jason Greenwald, från laboratoriet för fysikalisk kemi. I ett experiment, de har nu kunnat visa att amyloider kan fungera som en kemisk mall för syntes av korta peptider. Och den kritiska punkten:"Denna förmåga gäller potentiellt även amyloiden själv - vilket betyder att molekylerna kan replikera sig själv, " säger Riek. Forskarna rapporterade sina resultat i en studie i Naturkommunikation .
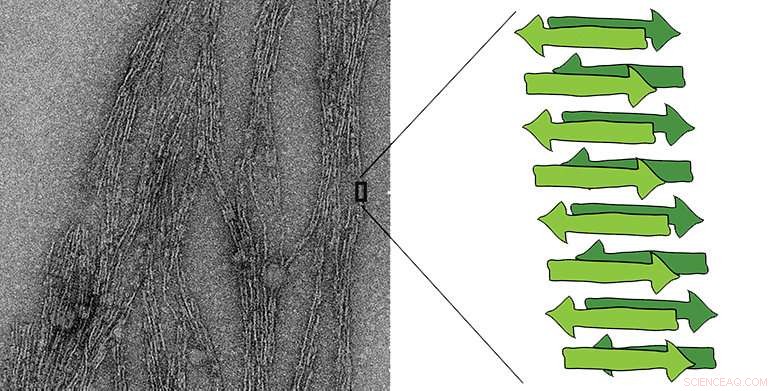
Till vänster:elektronmikrofotografi av en amyloidfiber. I grönt är ett diagram över arkstrukturen som är karakteristisk för amyloider, bestående av flera korta peptidkedjor. Kredit:Jason Greenwald/ETH Zürich
Mall för självreplikering
Förmågan att självreplikera ses som en väsentlig förutsättning för varje tidig livsform. Genom att bevisa att amyloider replikerar sig själv, Riek och hans team har inte bara lyft fram en annan fantastisk aspekt av detta ofta underskattade protein, men fyllde också i en tidigare saknad länk i amyloidhypotesens argument.
Nästan två år tidigare, ETH-forskarna hade redan bevisat i ett experiment att amyloidstrukturer spontant kan bildas med häpnadsväckande lätthet – från enkla aminosyror som förmodligen redan fanns när jorden fortfarande var livlös, och under reaktionsförhållanden som verkar mycket rimliga för ursoppan (som ETH News rapporterade).
Detsamma gäller för den nyupptäckta peptidsyntesen:"Reaktionsmekanismen verkar vara av allmän karaktär. Den är stabil över ett brett område av temperaturer och saltkoncentrationer, i både sura och alkaliska miljöer, " förklarar Greenwald.
Denna upptäckt stärker forskarnas uppfattning att tidigt i evolutionens historia, amyloider kunde ha spelat en central roll i utvecklingen av tidiga livsformer som informationsbärare och katalytiska enheter.

Självreplikeringsmekanismen för amyloidfibrer avbildad schematiskt:bit för bit, specifika aminosyror (färgade byggstenar) sätter sig på rätt plats och kombineras kemiskt. Under processen, den växande amyloiden fungerar som en mall för sig själv. Kredit:Lukas Frey/ETH Zürich
Inte bara en RNA-värld
Tills nu, dock, den mest utbredda idén för livets molekylära början har varit RNA-hypotesen, som ser ribonukleinsyra (RNA) som den enda nyckelspelaren i den prebiotiska ursoppan. Det här är för att, som det genetiska materialet DNA, RNA-molekyler kan koda information, och kan även replikera sig själv.
ETH-forskarna plockar nu bort den rådande dogmen om en RNA-baserad värld. De tror att amyloidhypotesen är mer rimlig; för det första, eftersom RNA-molekyler med en biologisk funktion är mycket större och mer komplexa, så det är osannolikt att de bildas spontant under prebiotiska förhållanden. "Dessutom, amyloider är mycket mer stabila än tidiga nukleinsyrapolymerer, och de har en mycket enklare abiotisk syntesväg jämfört med komplexiteten hos kända katalytiska RNA, säger Greenwald.
Riek tillägger:"Vi kommer aldrig att kunna bevisa vad som är sant – att göra det, vi skulle behöva vända tillbaka de senaste 4 till 4,5 miljarder år av evolution. Dock, vi misstänker att det inte var en, men flera molekylära processer med olika föregångare molekyler som var involverade i skapandet av liv."